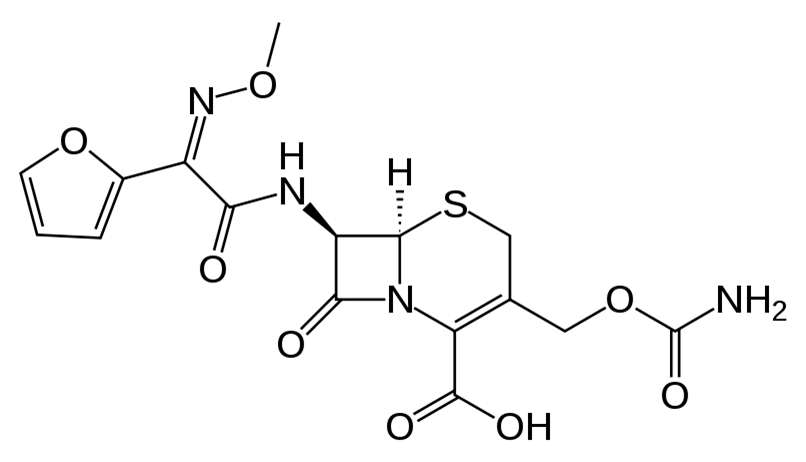
Pharmacocinétique - CÉFUROXIME - voie orale
Absorption
Après administration orale, le céfuroxime axétil, ester 1-acétoxy-éthyl de la céfuroxime, est rapidement hydrolysé par des estérases non spécifiques de la muqueuse intestinale.
Biodisponibilité du céfuroxime axétil:
Sous forme de comprimé:
elle est, après administration de la forme comprimé chez le sujet à jeun, de 30 à 40 %;
elle est augmentée par la prise d'aliments atteignant 50 à 60 %. Il est donc recommandé que le médicament soit absorbé 15 à 30 minutes après un repas.
Sous forme de granulé:
elle est, après administration de la forme granulé à jeun, inférieure de 20 à 25 % à celle de la forme comprimé;
elle n'est pas augmentée par la prise d'aliments pour cette forme.
Les Cmax suivantes ont été observées après une prise orale d'une dose unique de céfuroxime axétil:
10 mg/kg (granulé): 3,3 ± 0,8 mg/l.
15 mg/kg (granulé): 2,2 à 7,4 mg/l.
Elles sont atteintes en moyenne en 1 à 6 heures.
Chez l'adulte:
250 mg (comprimé): 4 à 6 mg/l.
500 mg (comprimé): 7 à 9 mg/l.
Elles sont atteintes en 2 à 3 heures après la prise du médicament lorsque celui-ci est donné après un repas.
Chez le sujet âgé:
500 mg (comprimé): 10,3 ± 6,1 mg/l.
Elle est atteinte en moyenne en 3 heures après une prise à jeun.
Après injection intramusculaire, l'absorption du produit est rapide et complète: la biodisponibilité de la céfuroxime administrée à la posologie de 500 mg est de 92 %.
Chez l'adulte, après administration intramusculaire d'une dose unique de 750 mg, la concentration plasmatique moyenne est de 17 mg/l et après injection de 500 mg de 12,3 mg/l; elle est atteinte en moyenne en 60 minutes.
Après administration IV d'une dose unique de 750 mg et de 1,5 g, les valeurs extrêmes des Cmax sont respectivement de 53 - 73 mg/l et de 101 - 168 mg/l.
Après administration de doses répétées, les paramètres pharmacocinétiques plasmatiques de la céfuroxime ne sont pas modifiés, traduisant l'absence d'accumulation du principe actif.
Distribution
Diffusion tissulaire
Le céfuroxime axétil a une bonne diffusion dans les tissus de l'appareil respiratoire et de la sphère ORL permettant d'obtenir des concentrations supérieures aux CMI des germes habituellement responsables d'infections respiratoires.
La diffusion tissulaire de la céfuroxime a été étudiée chez l'adulte après administration d'une dose de 500 mg de céfuroxime axétil (comprimé à jeun); les concentrations tissulaires suivantes ont été observées:
muqueuse bronchique: 2,3 à 8,0 mg/kg
crachats: 2,8 à 3,3 mg/l
liquide de recouvrement de l'épithélium pulmonaire (lavage bronchoalvéolaire): 0,2 à 7,6 mg/kg
muqueuse sinusale: 0,2 à 4,4 mg/kg
tissu amygdalien: 0,2 à 1,2 mg/kg
La diffusion tissulaire de la céfuroxime a été étudiée chez l'enfant après administration d'une dose de 250 mg de céfuroxime axétil (comprimés à jeun); les concentrations suivantes ont été observées dans le liquide auriculaire: 0,16 à 4,85 mg/l.
Une à 4 heures après injection IM d'une dose unique de 500 mg, les concentrations varient de 1,6 à 13,7 mg/l dans le parenchyme pulmonaire; 0,4 à 5,6 mg/l dans les sécrétions bronchiques.
La céfuroxime diffuse également bien dans la peau et le secteur interstitiel ainsi que dans la bile et la vésicule biliaire, le tissu osseux et articulaire, le tissu utérin et prostatique, le tissu rénal, le tissu cardiaque et l'humeur aqueuse.
Elle traverse facilement la barrière fto-placentaire. Le passage dans le lait maternel est extrêmement faible.
Elle ne traverse pas la barrière hémato-méningée sauf en cas d'inflammation des méninges.
Taux de liaison aux protéines plasmatiques:
Le taux de liaison aux protéines plasmatiques est faible, de l'ordre de 33 %.
Le volume apparent de distribution de la céfuroxime est de 25 - 30 l chez le sujet sain.
Elimination
La céfuroxime n'est pas métabolisée dans l'organisme et la quantité absorbée est éliminée à plus de 85 % par voie rénale sous forme inchangée dans les urines dans les 12 premières heures. L'élimination se fait à la fois par filtration glomérulaire et sécrétion tubulaire, cette dernière étant ralentie par le probénécide.
La demi-vie d'élimination après administration de céfuroxime axétil:
chez le nouveau-né à terme de moins de 1 mois: 3 à 5 fois plus élevée que chez l'adulte, de l'ordre de 4,5 heures chez le nouveau-né à terme de 4 jours;
chez l'enfant: est environ de 1,9 heures (granulé), chez l'enfant de plus de 1 mois, elle est de l'ordre de 1,1 heures après injection IM de 10 mg/kg;
chez l'adulte: est environ de 1,4 heures (comprimé), de 1,3 à 1,6 heures après injection IM (1,6 heures après 750 mg IM) et en moyenne de 1,1 heures après injection IV;
chez le sujet âgé: est augmentée, ne justifiant aucune réduction de la posologie tant que la clairance de la créatinine est supérieure à 40 ml/min;
en cas d'insuffisance rénale, augmente proportionnellement à la clairance de la créatinine justifiant une réduction de la posologie de moitié dès que la clairance de la créatinine est inférieure à 20 ml/min.
Pharmacocinétique - CÉFUROXIME - usage parentéral
Absorption
Après injection intramusculaire, l'absorption du produit est rapide et complète: la biodisponibilité de la céfuroxime administrée à la posologie de 500 mg est de 92 %.
Chez l'adulte; après administration intramusculaire d'une dose unique de 750 mg, la concentration plasmatique moyenne est de 17 mg/l et après injection de 500 mg de 12,3 mg/l; elle est atteinte en moyenne en 60 minutes.
Après administration IV d'une dose unique de 750 mg et de 1,5 g, les valeurs extrêmes de Cmax sont respectivement de 53-73 mg/l et de 101-168 mg/l.
Après administration orale, le céfuroxime axetil, ester 1-acétoxy-éthyl de la céfuroxime, est rapidement hydrolysé par des estérases non spécifiques de la muqueuse intestinale.
Biodisponibilité du céfuroxime axetil:
Sous forme de comprimé:
elle est, après administration de la forme comprimé chez le sujet à jeun, de 30 à 40 %;
elle est augmentée par la prise d'aliments atteignant 50 à 60 %. Il est donc recommandé que le médicament soit absorbé 15 à 30 minutes après un repas.
Sous forme de granulé:
elle est, après administration de la forme granulé à jeun, inférieure de 20 à 25 % à celle de la forme comprimé;
elle n'est pas augmentée par la prise d'aliments pour cette forme.
Les Cmax suivantes ont été observées après une prise orale d'une dose unique de céfuroxime axetil:
10 mg/kg (granulé): 3,3 ± 0,8 mg/l.
15 mg/kg (granulé): 2,2 ± 7,4 mg/l.
Elles sont atteintes en moyenne en 1 à 6 heures.
Chez l'adulte
250 mg (comprimé): 4 à 6 mg/l.
500 mg (comprimé): 7 à 9 mg/l.
Elles sont atteintes en 2 à 3 heures après la prise du médicament lorsque celui-ci est donné après un repas.
Chez le sujet âgé
500 mg (comprimé): 10,3 mg/l ± 6,1.
Elle est atteinte en moyenne en 3 heures après une prise à jeun.
Après administration IV et IM de doses multiples, les paramètres pharmacocinétiques sériques de la céfuroxime ne sont pas modifiés, traduisant l'absence d'accumulation du principe actif.
Distribution
Diffusion tissulaire
Le céfuroxime axetil a une bonne diffusion dans les tissus de l'appareil respiratoire et de la sphère ORL permettant d'obtenir des concentrations supérieures aux CMI des germes habituellement responsables d'infections respiratoires.
Une à 4 heures après injection IM d'une dose unique de 500 mg, les concentrations varient de 1,6 à 13,7 mg/l dans le parenchyme pulmonaire; 0,4 à 5,6 mg/l dans les sécrétions bronchiques.
La céfuroxime diffuse également bien dans la peau et le secteur interstitiel ainsi que dans la bile et la vésicule biliaire, le tissu osseux et articulaire, le tissu utérin et prostatique, le tissu rénal, le tissu cardiaque et l'humeur aqueuse.
Elle traverse facilement la barrière fto-placentaire. Le passage dans le lait maternel est extrêmement faible.
Elle ne traverse pas la barrière hémato-méningée sauf en cas d'inflammation des méninges.
La diffusion tissulaire de la céfuroxime a été étudiée chez l'adulte après administration d'une dose de 500 mg de céfuroxime axetil (comprimé à jeun); les concentrations tissulaires suivantes ont été observées:
muqueuse bronchique: 2,3 à 8,0 mg/kg
crachats: 2,8 à 3,3 mg/l
liquide de recouvrement de l'épithélium pulmonaire (lavage bronchoalvéolaire): 0,2 à 7,6 mg/kg
muqueuse sinusale: 0,2 à 4,4 mg/kg
tissu amygdalien: 0,2 à 1,2 mg/kg
La diffusion tissulaire de la céfuroxime a été étudiée chez l'enfant après administration d'une dose de 250 mg de céfuroxime axetil (comprimé à jeun); les concentrations suivantes ont été observées dans le liquide auriculaire: 0,16 à 4,85 mg/l.
Taux de liaison aux protéines plasmatiques:
Le taux de liaison aux protéines plasmatiques est faible, de l'ordre de 33 %.
Le volume apparent de distribution de la céfuroxime est de 25-30 l chez le sujet sain.
Elimination
La céfuroxime n'est pas métabolisée dans l'organisme et la quantité absorbée est éliminée à plus de 85 % par voie rénale sous forme inchangée dans les urines dans les 12 premières heures. L'élimination se fait à la fois par filtration glomérulaire et sécrétion tubulaire, cette dernière étant ralentie par le probénécide.
La demi-vie d'élimination après administration de céfuroxime axetil:
chez le nouveau-né à terme de moins de 1 mois: 3 à 5 fois plus élevée que chez l'adulte, de l'ordre de 4,5 heures chez le nouveau-né à terme de 4 jours;
chez l'enfant: est environ de 1,9 heures (granulé), chez l'enfant de plus de 1 mois, elle est de l'ordre de 1,1 heures après injection IM de 10 mg/kg;
chez l'adulte: est environ de 1,4 heures (comprimé), de 1,3 à 1,6 heures après injection IM (1,6 heures après 750 mg IM) et en moyenne de 1,1 heures après injection IV;
chez le sujet âgé: est augmentée, ne justifiant aucune réduction de la posologie tant que la clairance de la créatinine est supérieure à 40 ml/mn;
en cas d'insuffisance rénale, augmente proportionnellement à la clairance de la créatinine justifiant une réduction de la posologie de moitié dès que la clairance de la créatinine est inférieure à 20 ml/mn.
Granulés pour suspension buvable
Dans tous les cas, ne pas dépasser la posologie adulte:
Soit en cas d'angines, d'otites, d'infections respiratoires basses autres qu'une pneumopathie bactérienne: 500 mg/jour en 2 prises, qui est atteinte pour un enfant à partir de 17 kg.
Soit en cas de pneumopathie bactérienne: 1000 mg/jour en 2 prises, qui est atteinte pour un enfant à partir de 34 kg.
Infections de la sphère ORL, infections respiratoires basses autres qu'une pneumopathie bactérienne:
Enfants et nourrissons avec un poids < 17 kg:
Angines: 30 mg/kg/jour en 2 prises. La durée de traitement de certaines angines est de 4 jours.
Otites: 30 mg/kg/jour en 2 prises.
Infections respiratoires basses autres qu'une pneumopathie bactérienne: 30 mg/kg/jour en 2 prises.
Enfants et nourrissons avec un poids ≥ 17 kg:
Angines: 500 mg/jour en 2 prises. La durée de traitement de certaines angines est de 4 jours.
Otites: 500 mg/jour en 2 prises.
Infections respiratoires basses autres qu'une pneumopathie bactérienne: 500 mg/jour en 2 prises.
Pneumopathies bactériennes:
Enfants et nourrissons avec un poids < 34 kg: 30 mg/kg/jour en 2 prises.
Enfants avec un poids ≥ 34 kg: 1000 mg/jour en 2 prises.
La posologie recommandée est à prendre en 2 prises espacées de 12 heures, environ 15 à 30 minutes après les repas du matin et du soir.
En cas d'insuffisance rénale, l'élimination de la céfuroxime après prise orale de céfuroxime axétil est comparable à celle observée après administration parentérale de céfuroxime. Il est par conséquent recommandé, lorsque la clairance de la créatinine est inférieure à 20 ml par minute, de diminuer la dose de moitié en une seule prise orale par jour.
Ajouter une dose supplémentaire à chaque fin de dialyse chez les patients dialysés chroniques.
Ce médicament s'administre par voie orale au moyen d'une seringue pour administration orale graduée en kilogramme de 0 à 8 kg.
Mode d'administration:
Reconstitution de la suspension:
Remplir le godet avec de l'eau minérale non gazeuse ou de l'eau bouillie refroidie jusqu'au trait indicateur situé sur le côté du godet.
Verser dans le flacon, l'eau contenue dans le godet.
Pour obtenir une suspension homogène, agiter vigoureusement le flacon.
Placer immédiatement la suspension reconstituée entre 2°C et 8°C.
Avant la première utilisation de la seringue pour administration orale, laisser reposer la suspension reconstituée pendant au moins 20 minutes entre 2°C et 8°C (au réfrigérateur).
Administration avec la seringue pour administration orale:
Avant chaque utilisation, retourner le flacon 5 à 6 fois sans l'agiter vigoureusement.
Après chaque utilisation, remettre immédiatement le flacon entre 2°C et 8°C (au réfrigérateur).
La dose par prise est indiquée, en fonction du poids de l'enfant ou du nourrisson sur le piston de la seringue pour administration orale. La dose par prise se lit donc directement sur les graduations de la seringue pour administration orale. Ainsi le poids indiqué correspond à la dose pour une prise, sans dépasser un maximum de 17 graduations par prise en cas d'angines, d'otites moyennes aiguës ou d'infections respiratoires basses autres qu'une pneumopathie bactérienne, et de 34 graduations par prise en cas de pneumopathie bactérienne. Deux prises par jour sont nécessaires. |
Pour chaque prise:
jusqu'à 8 kg: remplir la seringue jusqu'à la graduation indiquant le poids de l'enfant;
En cas d'angines, d'otites moyennes aiguës ou d'infections respiratoires basses (autres qu'une pneumopathie bactérienne):
entre 8 kg et 17 kg: remplir une première fois la seringue jusqu'à la graduation 8 kg, puis une deuxième fois jusqu'à atteindre un total égal au poids de l'enfant (exemple pour un enfant de 15 kg: remplir une première fois la seringue jusqu'à la graduation 8 kg, puis une deuxième fois jusqu'à 7 kg);
au delà de 17 kg: chaque prise sera identique à celle d'un enfant de 17 kg.
En cas de pneumopathies bactériennes:
entre 8 kg et 34 kg: remplir une première fois la seringue jusqu'à la graduation 8 kg, puis un nombre de fois nécessaire jusqu'à atteindre un total égal au poids de l'enfant (exemple pour un enfant de 30 kg: remplir 3 fois la seringue jusqu'à la graduation 8 kg, puis une quatrième fois jusqu'à 6 kg);
au delà de 34 kg: chaque prise sera identique à celle d'un enfant de 34 kg, mais il est conseillé d'utiliser la forme sachet ou comprimé (enfant à partir de 6 ans pour le comprimé).
Dosage - CÉFUROXIME - usage parentéral
Poudre pour solution injectable
Voie intracamérulaire. Flacon à usage unique exclusivement.
Adultes
La dose recommandée est de 0,1 ml de solution reconstituée , soit 1 mg de céfuroxime.
NE PAS ADMINISTRER UNE DOSE SUPÉRIEURE À CELLE RECOMMANDÉE .
Population pédiatrique
La dose optimale et l'innocuité de CÉFUROXIME 50 mg, poudre pour solution injectable n'ont pas été établies dans la population pédiatrique.
Patients âgés
Aucun ajustement posologique n'est nécessaire.
Patients atteints d'insuffisance hépatique et rénale
Considérant la faible dose et le passage systémique négligeable de la céfuroxime attendu après utilisation de CÉFUROXIME, aucun ajustement posologique n'est nécessaire.
Mode d'administration
CÉFUROXIME doit être administré après reconstitution par injection intraoculaire dans la chambre antérieure de l'il (injection intracamérulaire), par un chirurgien ophtalmologiste dans les conditions d'asepsie recommandées pour une chirurgie de la cataracte.
Après reconstitution, CÉFUROXIME doit être contrôlé visuellement afin de vérifier l'absence de particules et de coloration anormale avant administration.
Injecter lentement 0,1 ml de solution reconstituée dans la chambre antérieure de l'il en fin de chirurgie de la cataracte.
Un flacon ne doit servir qu'au traitement d'un seul et unique il.
Un flacon contient une dose supérieure à celle recommandée de 1 mg (équivalente à 0,1 ml). Le volume de solution reconstituée pouvant être extrait du flacon (5 ml) ne doit pas être utilisé dans son intégralité.
L'administration du volume intégral serait synonyme de surdosage.
Après injection, tout produit non utilisé doit être jeté.
Poudre pour perfusion
Chez les sujets aux fonctions rénales normales
Adultes:
traitement curatif: 1,5 g à 2 g/jour en moyenne
prophylaxie des infections post-opératoires en chirurgie: l'antibioprophylaxie doit être de courte durée, le plus souvent limitée à la période per-opératoire, 24 heures parfois, mais jamais plus de 48 heures.
Injection intra-veineuse de 1,5 g à l'induction anesthésique à perfuser en 20 à 30 minutes,
Puis réinjection de 750 mg IV toutes les 2 heures jusqu'à la fin de l'intervention.
Dans la chirurgie cardiaque et orthopédique, des réinjections de 750 mg toutes les 6-8 heures peuvent être effectuées pendant 24 heures, sans dépasser 48 heures.
Dans la chirurgie cardiaque avec circulation extra-corporelle (CEC), une injection supplémentaire de 1,5 g doit être effectuée après branchement de la CEC.
Pour les résections transuréthrales de prostate et les biopsies de prostate, une seule dose suffit.
Enfants et nourrissons:
traitement curatif: 30 à 60 mg/kg/jour en moyenne.
Chez les insuffisants rénaux
En cas d'insuffisance rénale, la posologie est adaptée en fonction de la clairance de la créatinine ou de la créatininémie. (cf. tableau):
| Nourrisson et enfant | Adulte |
| Créatininémie mg °/oo | Posologie minimum | Posologie maximum | Posologie maximum |
Inférieur à 25 | 30 mg/kg/j en 4 prises | 60 mg/kg/j en 4 prises | 750 mg à 1500 mg 3 fois /j |
25 à 60 | 15 mg/kg/j | 30 mg/kg/j en 2 prises | 750 mg à 1500 mg 2 fois/j |
Supérieur à 60 | 15 mg/kg/48 h | 30 mg/kg/36 h | 750 mg à 1500 mg 1 fois/j |
Anurie | 15 mg/kg/48 h | 30 mg/kg/36 h | 750 mg à 1500 mg 1 fois/36 h |
Dialyse | 250 mg/48 h + 125 mg en fin de dialyse | 250 mg/36 h + 250 mg en fin de dialyse | 750 mg à 1500 mg par 24 h + la même dose en fin de dialyse |
Mode d'administration
Perfusion:
utiliser, pour préparer la solution, le flacon de perfusion dans lequel se trouve la poudre de céfuroxime 1,5 g;
ajouter 50 ml d'eau pour préparation injectable; Le flacon peut être utilisée comme flacon à perfusion ou la solution obtenue peut être transférée dans une autre poche à perfusion.
passer la totalité de la solution ainsi obtenue en 20 à 30 minutes.

 Français
Français Русский
Русский