Pharmacodynamique
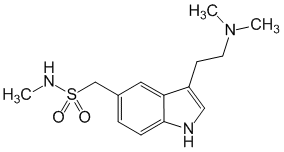
Le sumatriptan est un agoniste sélectif des récepteurs vasculaires à la 5-hydroxytryptamine-1 (5HT1d) sans effet sur les autres sous-types de récepteurs 5HT (5HT2 à 5HT7). Les récepteurs vasculaires 5HT1d sont localisés principalement au niveau des vaisseaux sanguins crâniens et induisent une vasoconstriction.
Chez l'animal, le sumatriptan est responsable d'une vasoconstriction sélective de la circulation artérielle carotidienne. La circulation artérielle carotidienne vascularise les tissus extracrâniens et intracrâniens tels que les méninges. On pense que la dilatation et/ou la formation d'dèmes au niveau de ces vaisseaux pourraient correspondre au mécanisme de la migraine chez l'homme. De plus, les résultats des études chez l'animal indiquent que le sumatriptan inhibe l'activité du nerf trijumeau. Ces deux actions (vasoconstriction crânienne et inhibition de l'activité du nerf trijumeau) pourraient contribuer à l'action anti-migraineuse du sumatriptan chez l'homme.
Pharmacocinétique
Pharmacocinétique - SUMATRIPTAN - voie orale
Après administration orale, le sumatriptan est rapidement absorbé. La concentration maximale est atteinte après 2 (0,5 - 5) heures.
La biodisponibilité absolue par voie orale est de 14 % en moyenne. Ceci est dû en partie à un métabolisme pré-systémique et en partie à une absorption incomplète.
Chez les patients présentant une insuffisance hépatique, la clairance pré-systémique après administration par voie orale est réduite donnant lieu à une élévation des taux plasmatiques de sumatriptan.
La demi-vie d'élimination est d'environ 2 heures.
La liaison aux protéines plasmatiques est faible (14-21 %), le volume de distribution total moyen est de 170 litres. La clairance totale moyenne est d'environ 1160 ml/min et la clairance rénale moyenne est d'environ 260 ml/min. La clairance non rénale représente environ 80 % de la clairance totale suggérant que le sumatriptan est éliminé principalement par métabolisme oxydatif par la monoamine-oxydase A. Le métabolite principal, l'analogue acide indolacétique du sumatriptan, est principalement excrété dans les urines, sous forme d'acide libre ou de glucuroconjugué. Il n'a pas d'activité 5HT1 ou 5HT2 connue. Les métabolites mineurs n'ont pas été identifiés. La pharmacocinétique du sumatriptan administré par voie orale n'est pas affectée par la crise de migraine.
Sujets âgés
La cinétique chez les patients âgés n'a pas été suffisamment étudiée pour permettre de conclure quant à d'éventuelles différences pharmacocinétiques entre les volontaires âgés et jeunes.
Pharmacocinétique - SUMATRIPTAN - usage parentéral
Après administration d'une injection sous-cutanée, le sumatriptan a une biodisponibilité moyenne élevée (96 %). Le pic plasmatique est de 72 ng/ml atteint en 25 minutes après une dose sous-cutanée de 6 mg. Les concentrations plasmatiques mesurées 1 heure après l'administration sous-cutanée sont d'approximativement 23 ng/ml.
Après une administration orale, le sumatriptan est rapidement absorbé et 70 % de la concentration maximale est atteinte en 45 minutes. Le pic de concentration plasmatique moyen après une administration de 100 mg est de 54 ng/ml (pouvant aller de 24 à 71 ng/ml). La biodisponibilité absolue moyenne est de 14 % (pouvant aller de 10 à 20 %), suite à une métabolisation présystémique et à une absorption incomplète.
Les paramètres pharmacocinétiques plasmatiques du sumatriptan après une administration sous-cutanée de doses uniques de 6 mg sumatriptan avec SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille ont été comparés avec ceux obtenus avec la même dose administrée en utilisant un produit de référence injectable par une aiguille pour injection dans la paroi abdominale ou dans la cuisse. Vingt-quatre volontaires en bonne santé ont été évalués dans une étude ouverte randomisée croisée en 4 phases; chaque sujet a été évalué avec chaque formulation (SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille et produit de référence) pour chaque site d'injection (paroi abdominale et cuisse).
Les évolutions du taux plasmatique de sumatriptan étaient très similaires pour les deux produits (Figure 1).
SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille et le produit de référence étaient similaires en termes de vitesse et de la biodisponibilité systémique et leurs paramètres pharmacocinétiques étaient bioéquivalents en termes de pic (Cmax), d'exposition totale (ASC0-tz, ASC0-∞) et d'exposition précoce (ASC0-15 min). (Voir le tableau 2.) On n'a pas observé de différences cliniquement significatives entre SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille et le produit de référence pour les valeurs médianes de tmax et de la demi-vie terminale apparente (t1/2).
Figure 1: Evolutions des moyennes géométriques de la concentration plasmatique après une administration unique de 6 mg de sumatriptan par voie sous-cutanée avec SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille et avec le produit de référence
Evolutions dans le temps des moyennes géométriques de la concentration plasmatique (N: 24) après une administration unique de 6 mg de sumatriptan avec SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille et avec le produit de référence (Sumatriptan Injection); administration dans la paroi abdominale (cadre de gauche) et dans la cuisse (cadre de droite)
Tableau 2. Données pharmacocinétiques et de bioéquivalence pour SUMATRIPTAN 6 mg/0,5 ml, solution injectable en injecteur sans aiguille par rapport à Sumatriptan Injection; applications dans la paroi abdominale ou dans la cuisse
Abdomen (N: 24)
| SUMATRIPTAN 6 mg/0,5 ml Moyenne (CV) | Sumatriptan Injection Moyenne (CV) | |
Concentration plasmatique maximale | 89,1 | 98,8 | |
Cmax (ng/ml) | (0,26) | (0,30) | |
Aire sous la courbe quantifiable | 77,9 | 83,6 | |
ASC0-tz (ng⋅h/ml) | (0,24) | (0,25) | |
Aire sous la courbe entre 0 et 15 | 16,3 | 17,2 | |
minutes - ASC0-15 min (ng⋅h/ml) | (0,32) | (0,34) | |
Temps d'obtention du pic | 12 | 11 | |
tmax * (min) | (6 - 15) | (6 - 20) | |
Moyennes géométriques et coefficients de variation géométriques (CV) pour Cmax et ASC; médiane et plage pour tmax.
Cuisse (N: 24)
| SUMATRIPTAN 6 mg/0,5 ml Moyenne | Sumatriptan Injection Moyenne | |
Concentration plasmatique maximale | 76,0 | 76,1 | |
Cmax (ng/ml) | (0,33) | (0,45) | |
Aire sous la courbe quantifiable | 76,8 | 75,0 | |
ASC0-tz (ng⋅h/ml) | (0,26) | (0,44) | |
Aire sous la courbe entre 0 et 15 | 13,3 | 12,8 | |
minutes - ASC0-15 min (ng⋅h/ml) | (0,37) | (0,47) | |
Temps d'obtention du pic | 12 | 15 | |
tmax * (min) | (3 - 30) | (9 - 30) | |
Moyennes géométriques et coefficients de variation géométriques (CV) pour Cmax et ASC; médiane et plage pour tmax.
La liaison aux protéines plasmatiques est faible (14-21 %), le volume de distribution moyen est de 170 litres.
La demi-vie d'élimination est d'environ 2 heures.
La clairance plasmatique moyenne est d'environ 1160 ml/min et la clairance plasmatique rénale moyenne est d'environ 260 ml/min. La clairance non rénale représente environ 80 % de la clairance totale. Le sumatriptan est éliminé tout d'abord par métabolisation oxydative due à la monoamine oxydase A.
Le principal métabolite, l'analogue acide indolacétique du sumatriptan, est principalement excrété dans les urines, où il est retrouvé sous forme d'acide libre et de glucuroconjugué. Il n'a pas d'activité 5HT1 ou 5HT2 connue. Les métabolites mineurs n'ont pas été identifiés.
Pharmacocinétique - SUMATRIPTAN - application locale en ORL (otorhinolaryngologie)
Absorption
Après administration nasale, Ie sumatriptan est rapidement absorbé, la concentration plasmatique maximale étant atteinte en 1 - 1,5 heures. Après une dose de 20 mg, la concentration plasmatique maximale moyenne est de 13 ng/ml.
La biodisponibilité moyenne après administration par voie nasale est d'environ 16 % de celle après administration sous-cutanée, à cause en partie du métabolisme pré-systémique.
Distribution
La liaison aux protéines plasmatiques est faible (14-21 %), le volume de distribution total moyen est de 170 litres. La demi-vie d'élimination est d'environ 2 heures. La clairance plasmatique moyenne est d'environ 1160 ml/min et la clairance plasmatique rénale moyenne est d'environ 260 ml/min.
Elimination
La clairance non rénale représente environ 80 % de la clairance totale. Le sumatriptan est éliminé tout d'abord par métabolisme oxydatif dû à la monoamine-oxydase A. Le principal métabolite, l'analogue acide indolacétique du sumatriptan, est principalement excrété dans les urines, où il est retrouvé sous forme d'acide libre ou de glucuroconjugué. II n'a pas d'activité 5HT1 ou 5HT2 connue.
Les métabolites mineurs n'ont pas été identifiés. La pharmacocinétique du sumatriptan par voie nasale ne semble pas être significativement modifiée par la crise de migraine.
Populations spéciales de patients
Insuffisance hépatique
Après administration par voie orale, la clairance pré-systémique est réduite chez les patients insuffisants hépatiques, provoquant une augmentation des taux plasmatiques de sumatriptan. Une augmentation similaire pourrait survenir après administration nasale .
Adolescents (12- 17 ans)
Une étude pharmacocinétique chez des sujets adolescents (12-17 ans) indique que la concentration plasmatique maximale moyenne est de 13,9 ng/ml et que la demi-vie moyenne d'élimination est de 2 heures après administration de 20 mg par voie nasale. Un modèle de cinétique de population a permis de montrer que la clairance et le volume de distribution augmentent avec la taille de l'adolescent, entraînant une exposition plus importante chez les adolescents de poids corporel plus faible.
Patients âgés
La cinétique chez le sujet âgé n'a pas été suffisamment étudiée pour justifier la mention de possibles différences entre les cinétiques chez des volontaires âgés et chez des volontaires jeunes.
Dosage
Dosage - SUMATRIPTAN - voie orale
Comprimé
Le sumatriptan ne doit pas être utilisé en prophylaxie.
Il est recommandé d'utiliser le sumatriptan en monothérapie dans le traitement de la crise de migraine et de ne pas le donner de façon concomitante avec de l'ergotamine ou des dérivés de l'ergotamine (y compris le méthysergide) .
Il est conseillé de prendre le sumatriptan aussi précocement que possible après le début d'une crise de céphalée migraineuse. Son efficacité est identique quel que soit le stade de la crise durant lequel il est administré.
Adultes
La dose recommandée chez l'adulte est d'un comprimé à 50 mg.
Chez certains patients la dose de 100 mg peut être nécessaire.
Si un patient n'est pas soulagé après la première dose, une seconde dose ne doit pas être prise au cours de la même crise. Le sumatriptan pourra être utilisé pour les crises suivantes.
Si un patient a été soulagé après la prise du premier comprimé mais que les symptômes réapparaissent, une ou deux doses supplémentaires peuvent être utilisées dans les 24 heures suivantes à condition de respecter un intervalle d'au-moins 2 heures entre les 2 prises sans dépasser 300 mg par 24 heures.
Les comprimés doivent être avalés entiers avec de l'eau.
Enfants (de moins de 12 ans)
L'utilisation du sumatriptan n'est pas recommandée chez l'enfant de moins de 12 ans compte tenu que la sécurité d'emploi et l'efficacité n'ont pas été étudiées.
Adolescents (de 12 à 17 ans)
L'efficacité du sumatriptan chez les adolescents n'a pas été démontrée dans les études cliniques réalisées dans cette population. Par conséquent, l'utilisation de sumatriptan chez l'adolescent n'est pas recommandée .
Sujets âgés (de plus de 65 ans)
Il n'existe pas de données suffisantes concernant l'utilisation du sumatriptan chez les patients de plus de 65 ans. La cinétique chez les patients âgés ne diffère pas de manière significative de celle observée chez une population plus jeune. L'utilisation du sumatriptan n'est pas recommandée tant que des données complémentaires ne seront pas disponibles.
Insuffisance hépatique
Chez le patient présentant une insuffisance hépatique légère à modérée: l'utilisation de doses plus faibles, comprises entre 25 et 50 mg, doit être envisagée chez ces patients.
Insuffisance rénale
Le sumatriptan doit être utilisé avec précaution chez les patients présentant une insuffisance rénale.
Dosage - SUMATRIPTAN - usage parentéral
Solution injectable
Ne pas dépasser les recommandations posologiques suivantes:
Traitement de la crise de migraine
La posologie recommandée de SUMATRIPTAN est de 1 administration sous-cutanée unique de 6 mg. L'augmentation de la dose par l'administration de doses répétées n'améliore pas la réponse. Une deuxième dose peut être utilisée seulement si le patient a été soulagé après la première injection mais que les symptômes réapparaissent, à condition de respecter un intervalle d'au moins 1 heure entre les 2 doses.
La posologie maximale par 24 heures est de 2 administrations de 6 mg (soit 12 mg).
Si un patient n'a pas été soulagé par une dose de SUMATRIPTAN , une seconde dose ne doit pas être utilisée pour la même crise. Il est possible d'utiliser des médicaments à base d'aspirine, d'anti-inflammatoires non stéroïdiens ou de paracétamol pour le traitement de cette crise. SUMATRIPTAN peut être utilisé pour traiter des crises suivantes.
Il est recommandé d'utiliser SUMATRIPTAN en monothérapie dans le traitement de la crise de migraine et de ne pas le donner de façon concomitante avec de l'ergotamine ou des dérivés de l'ergotamine (y compris le méthysergide) .
Il est conseillé de prendre le traitement aussi précocement que possible dès la survenue de la crise de migraine ou des symptômes associés comme les nausées, vomissements, photophobie. Cependant, le produit est aussi efficace quel que soit le stade de la crise durant lequel il est administré. L'administration durant l'aura migraineuse, avant la survenue de tous les autres symptômes, peut ne pas prévenir le développement de la céphalée.
Traitement de la crise d'algie vasculaire de la face
La posologie recommandée chez l'adulte est de 1 administration sous-cutanée de 6 mg par crise. L'augmentation de la dose par l'administration de doses répétées n'améliore pas la réponse. Une deuxième dose peut être utilisée seulement si le patient a été soulagé après la première injection mais que les symptômes réapparaissent, à condition de respecter un intervalle d'au moins 1 heure entre les 2 doses.
La posologie maximale par 24 heures est de 2 administrations de 6 mg (soit 12 mg).
Patient âgé (de plus de 65 ans)
Il n'y a pas d'expérience de l'utilisation de SUMATRIPTAN chez les patients âgés de plus de 65 ans. La pharmacocinétique n'a pas suffisamment été étudiée dans cette population. Par conséquent, tant que des données cliniques complémentaires ne seront pas disponibles, l'utilisation du sumatriptan chez les patients âgés de plus de 65 ans n'est pas recommandée.
Enfants et adolescents (de moins de 18 ans)
L'utilisation de SUMATRIPTAN n'est pas recommandée chez les enfants et les adolescents (moins de 18 ans) compte tenu de l'absence de données de l'utilisation de SUMATRIPTAN dans ces catégories d'âges.
Mode d'administration
SUMATRIPTAN est adapté pour être auto-administré dans l'abdomen ou la cuisse. Il n'est pas adapté pour être administré dans d'autres parties du corps notamment les bras. SUMATRIPTAN doit être administré par voie sous-cutanée et non par voie intramusculaire ou intraveineuse.
SUMATRIPTAN doit être utilisé immédiatement après la préparation de l'injecteur sans aiguille. Les patients doivent être prévenus de lire attentivement « les instructions pour l'utilisation » à la fin de la Notice.
Dosage - SUMATRIPTAN - application locale en ORL (otorhinolaryngologie)
Solution pour pulvérisation
Adultes (à partir de 18 ans)
La dose recommandée est d'une pulvérisation de 20 mg administrée dans une seule narine.
Cependant, en raison de la variabilité inter et intra individuelle des patients, aussi bien des crises de migraine que de l'absorption de sumatriptan, une dose de 10 mg peut s'avérer efficace chez certains patients.
Pour les patients non soulagés par la dose de 10 mg, la dose de 20 mg peut s'avérer nécessaire lors de la crise suivante.
En l'absence de soulagement après la première dose, il n'est pas recommandé d'administrer une deuxième dose au cours de la même crise. Toutefois, cette crise peut être traitée avec du paracétamol, de l'acide acétylsalicylique, ou des anti-inflammatoires non-stéroïdiens. Le sumatriptan pourra être utilisé pour les crises suivantes.
Si un patient a été soulagé après la première prise mais que les symptômes réapparaissent, une seconde dose peut être utilisée dans les 24 heures suivantes à condition de respecter un intervalle d'au moins 2 heures entre les 2 administrations.
Ne pas utiliser plus de 2 pulvérisations de 20 mg de sumatriptan solution pour pulvérisation nasale par 24 heures.
Adolescents (12-17 ans)
L'utilisation de sumatriptan chez les adolescents doit se faire selon les recommandations d'un médecin spécialiste de la migraine, en tenant compte des recommandations nationales.
La dose recommandée est d'une pulvérisation de 10 mg de sumatriptan solution pour pulvérisation nasale administrée dans une seule narine.
En l'absence de soulagement après la première dose, il n'est pas recommandé d'administrer une deuxième dose au cours de la même crise. Toutefois, cette crise peut être traitée avec du paracétamol, de l'acide acétylsalicylique, ou des anti-inflammatoires non-stéroïdiens. Le sumatriptan pourra être utilisé pour les crises suivantes.
Si un patient a été bien soulagé à la première prise mais que les symptômes réapparaissent, une seconde dose peut être utilisée dans les 24 heures suivantes à condition de respecter un intervalle d'au moins 2 heures entre les 2 administrations.
Ne pas utiliser plus de deux pulvérisations de 10 mg de sumatriptan solution pour pulvérisation nasale par 24 heures.
Enfant (de moins de 12 ans)
L'utilisation du sumatriptan par voie nasale n'est pas recommandée chez les enfants de moins de 12 ans en raison du manque de données sur la sécurité et l'efficacité du sumatriptan chez l'enfant.
Patient âgé (de plus de 65 ans)
Il n'existe pas de données concernant l'utilisation du sumatriptan par voie nasale chez les patients de plus de 65 ans. La cinétique chez les patients âgés n'a pas été suffisamment étudiée. C'est pourquoi, l'utilisation du sumatriptan n'est pas recommandée tant que des données complémentaires ne seront pas disponibles.
Mode d'administration
Le sumatriptan ne doit pas être utilisé en prophylaxie.
Ne pas dépasser la dose recommandée de sumatriptan.
Il est recommandé d'utiliser le sumatriptan en monothérapie dans le traitement de la crise de migraine et de ne pas le donner de façon concomitante avec de l'ergotamine ou des dérivés (y compris le méthysergide) .
Il est conseillé de prendre le sumatriptan aussi précocement que possible dès la survenue de la crise migraineuse. Son efficacité est identique quel que soit le stade de la crise durant lequel il est administré.
Indications
Indications - SUMATRIPTAN - usage systémique
Traitement de:
la crise de migraine, avec ou sans aura,
de la crise d'algie vasculaire de la face (Syndrome de Bing-Horton).
SUMATRIPTAN ne devra pas être utilisé comme traitement prophylactique.
Indications - SUMATRIPTAN - application locale en ORL (otorhinolaryngologie)
Le sumatriptan est indiqué dans le traitement de la crise de migraine avec ou sans aura. La forme solution pour pulvérisation nasale est particulièrement adaptée aux patients présentant des nausées et des vomissements au cours d'une crise.
Contre-indications
Le sumatriptan ne doit pas être donné aux patients ayant des antécédents d'infarctus du myocarde ou une pathologie cardiaque ischémique, un vasospasme coronarien (angor de Printzmetal), une pathologie vasculaire périphérique ou aux patients présentant des symptômes de pathologie cardiaque ischémique ou des signes compatibles avec une pathologie cardiaque ischémique.
Le sumatriptan ne doit pas être administré aux patients présentant des antécédents d'accident vasculaire cérébral (AVC) ou d'accident ischémique transitoire (AIT).
Le sumatriptan ne doit pas être administré aux patients ayant une insuffisance hépatique sévère.
L'utilisation du sumatriptan est contre-indiquée chez les patients ayant une hypertension modérée ou sévère.
L'utilisation du sumatriptan est contre-indiquée chez les patients ayant une hypertension légère traitée non contrôlée.
L'association du sumatriptan avec l'ergotamine ou les dérivés de l'ergotamine ou de tout autre triptan/agoniste 5-HydroxyTryptamine1 (5-HT1) (y compris le méthysergide) est contre-indiquée .
L'association du sumatriptan avec les inhibiteurs de la monoamine oxydase (IMAO) est contre-indiquée.
Le sumatriptan ne doit pas être utilisé dans les 2 semaines suivant l'arrêt d'un traitement par les inhibiteurs de la monoamine oxydase.
Effets indésirables
Effets indésirables - SUMATRIPTAN - usage systémique
Les effets indésirables sont classés ci-dessous par système-organe et par fréquence.
La classification selon la fréquence utilise la convention suivante: très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1 000 et< 1/100), rare (≥ 1/10 000 et < 1/1 000) et très rare (< 1/10 000), incluant les cas isolés, inconnu (ne pouvant pas être estimé sur la base des données disponibles). Certains symptômes rapportés comme effets indésirables peuvent être considérés comme des symptômes associés à la migraine.
Les effets secondaires les plus fréquents associés au traitement avec le sumatriptan administré par voie sous-cutanée sont une douleur transitoire au niveau du site d'injection, un léger saignement, une ecchymose, un gonflement et un érythème.
Bien qu'on ne dispose pas de comparaisons directes, des bouffées vasomotrices, une paresthésie et des sensations de chaleur, de pression et de lourdeur pourraient être plus fréquentes après une injection sous-cutanée de sumatriptan.
Par contre, les nausées, les vomissements et la fatigue semblent être moins fréquents après une injection sous-cutanée qu'après la prise de comprimés.
Affections du système immunitaire
Inconnu: réactions d'hypersensibilité allant d'une allergie cutanée à une réaction anaphylactique.
Affections psychiatriques
Inconnu: anxiété.
Affections du système nerveux
Fréquent: vertiges, somnolence, troubles de la sensibilité dont paresthésie et hypoesthésie.
Inconnu: convulsions, bien que certaines de ces convulsions soient survenues chez des patients présentant soit des antécédents de convulsions, soit des facteurs de risque de convulsions. Quelques cas ont été rapportés chez des patients en l'absence de tels facteurs de risque. Tremblements, dystonie, nystagmus, scotome.
Affections oculaires
Inconnu: papillotements, diplopie, baisse de la vision. Perte de la vision, dont certains cas peuvent être permanents. Toutefois, des troubles visuels peuvent également survenir au cours de la crise de migraine.
Affections cardiaques
Inconnu: bradycardie, tachycardie, palpitations, arythmies cardiaques, signes ischémiques transitoires à l'ECG, vasospasme des artères coronaires, angor, infarctus du myocarde .
Affections vasculaires
Fréquent: augmentations transitoires de la pression artérielle survenant juste après le traitement, flush.
Inconnu: hypotension, syndrome de Raynaud.
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée
Affections gastro-intestinales
Fréquent: Des nausées et vomissements sont survenus chez certains patients, sans que l'on puisse déterminer si ces symptômes sont liés au SUMATRIPTAN ou à la pathologie sous-jacente.
Inconnu: colites ischémiques, diarrhées.
Affections de la peau et du tissus sous-cutané
Inconnu: hyperhidrose.
Affections musculo-squelettiques et systémiques
Fréquent: sensation de lourdeur (habituellement transitoire, mais pouvant être intense et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge). Myalgies.
Inconnu: raideur de la nuque, arthralgies.
Troubles généraux et anomalies au site d'administration
Très fréquent: douleur transitoire au site d'injection. Piqûre/brûlure, gonflement, érythème, hématome et saignements au site d'injection, ont aussi été rapportés.
Fréquent: douleur, sensation de chaleur ou de froid, de pression ou d'oppression (ces effets sont habituellement transitoires, mais ils peuvent être intenses et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge). Sensation de faiblesse, fatigue (ces deux effets sont le plus souvent d'intensité faible à modérée et transitoires).
Investigations
Très rare: Des perturbations mineures des tests hépatiques ont été occasionnellement observées.
Effets indésirables - SUMATRIPTAN - application locale en ORL (otorhinolaryngologie)
Les effets indésirables sont classés ci-dessous par système-organe et par fréquence. La classification selon la fréquence utilise la convention suivante : très fréquents (≥1/10), fréquents (≥1/100 à<1/10), peu fréquents (≥1/1 000 à <1/100), rares (≥1/10 000 à <1/1 000) ; très rares (<1/10 000) et fréquence indéterminée (ne pouvant être estimée à partir des données disponibles).
Liés à la forme pharmaceutique
Des effets indésirables rapportés chez l'adulte ont également été observés chez l'adolescent. Ces effets incluent de très rares cas de vasospasme coronaire et d'infarctus du myocarde .
Affections du système nerveux :
Très fréquent : dysgueusie/goût désagréable
Affections respiratoires, thoraciques et médiastinales :
Fréquent : après administration de sumatriptan en pulvérisation nasale, des cas d'irritation légère et transitoire ou de sensation de brûlure au niveau du nez ou de la gorge et d'épistaxis ont été rapportés.
Généraux
Certains des symptômes rapportés comme un effet indésirable peuvent être associés aux symptômes de la migraine.
Affections du système immunitaire :
Fréquence indéterminée : réactions d'hypersensibilité allant d'une allergie cutanée (comme l'urticaire) à une réaction anaphylactique.
Affections du système nerveux :
Fréquents : vertiges, somnolence, troubles de la sensibilité dont paresthésie et hypoesthésie.
Fréquence indéterminée :
crises convulsives, bien que certaines de ces convulsions soient survenues chez des patients présentant soit des antécédents de convulsions soit des conditions prédisposant aux convulsions. Quelques cas ont été rapportés chez des patients qui n'avaient pas de conditions apparentes prédisposant aux convulsions.
tremblements, dystonie, nystagmus, scotome.
Affections oculaires :
Fréquence indéterminée : troubles visuels tels que papillotements, diplopie, baisse de la vision. Perte de la vision, dont certains cas peuvent être permanents. Toutefois, des troubles visuels peuvent également survenir au cours de la crise de migraine elle-même.
Affections cardiaques :
Fréquence indéterminée : bradycardie, tachycardie, palpitations, arythmies cardiaques, signes ischémiques transitoires à l'ECG, vasospasme des artères coronaires, angor, infarctus du myocarde .
Affections vasculaires :
Fréquents : augmentations transitoires de la pression artérielle survenant juste après le traitement, flush.
Fréquence indéterminée : hypotension et syndrome de Raynaud.
Affections respiratoires, thoraciques et médiastinales :
Fréquent : dyspnée.
Affections gastro-intestinales :
Fréquents : des nausées et vomissements sont survenus chez certains patients, sans que l'on puisse déterminer si ces symptômes sont liés au sumatriptan ou à la pathologie sous-jacente.
Fréquence indéterminée : colites ischémiques, diarrhées.
Affections musculo-squelettiques et systémiques :
Fréquents :
sensation de lourdeur (habituellement transitoire, mais pouvant être intense et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge).
myalgie.
Fréquence indéterminée : raideur de la nuque, arthralgie.
Troubles généraux et anomalies au site d'administration :
Fréquents :
douleur, sensation de chaleur ou de froid, de pression ou d'oppression (ces effets sont habituellement transitoires, mais ils peuvent être intenses et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge).
sensation de faiblesse, fatigue (ces deux effets sont le plus souvent d'intensité faible à modérée et transitoires).
Investigations :
Très rares : des perturbations mineures des tests hépatiques ont été occasionnellement observées.
Affections psychiatriques :
Fréquence indéterminée : anxiété.
Affections de la peau et du tissu sous-cutané :
Fréquence indéterminée : hyperhidrose.
Surdosage
Signes et symptômes
Des doses uniques allant jusqu'à 40 mg par voie nasale et dépassant 16 mg par voie sous-cutanée et 400 mg par voie orale n'ont pas entraîné d'effets indésirables autres que ceux mentionnés.
Au cours des études cliniques, des volontaires ont reçu 20 mg de sumatriptan par voie nasale 3 fois par jour pendant 4 jours sans effets indésirables significatifs.
Traitement
En cas de surdosage, le patient doit être mis sous surveillance pendant au moins 10 heures et un traitement symptomatique standard doit être administré, si nécessaire. L'effet de l'hémodialyse ou de la dialyse péritonéale sur les concentrations plasmatiques de sumatriptan n'est pas connu.
Grossesse/Allaitement
Grossesse
Des données d'après commercialisation, provenant de l'utilisation du
sumatriptan au cours du premier trimestre de la grossesse chez plus de 1000 femmes, sont disponibles.
Bien que ces données soient insuffisantes pour tirer des conclusions définitives, elles ne montrent pas une augmentation du risque tératogène. L'expérience de l'utilisation du sumatriptan au cours du deuxième et troisième trimestre de la grossesse est limitée.
Les études chez l'animal n'indiquent pas d'effets tératogènes directs ou des effets nuisibles sur le développement péri et post-natal. Toutefois, la viabilité embryofoetale peut être altérée chez le lapin .
En conséquence, l'administration de sumatriptan ne doit être envisagée que si le bénéfice attendu pour la mère est supérieur aux risques possibles pour le ftus.
Allaitement
Il a été démontré qu'après administration sous-cutanée le sumatriptan est excrété dans le lait maternel. L'exposition du nourrisson peut être minimisée en évitant l'alimentation au lait maternel dans les 12 heures suivant le traitement. Le lait collecté pendant cette période doit être éliminé.
Interactions avec d'autres médicaments
Il n'a pas été mis en évidence d'interaction avec le propranolol, la flunarizine, le pizotifène ou l'alcool. Les données concernant l'interaction du sumatriptan avec les médicaments contenant de l'ergotamine ou un autre triptan/agoniste du récepteur 5-HT1 sont limitées. Le risque accru de vasospasme coronarien est théoriquement possible. L'administration concomitante de ces produits est donc contre-indiquée .Le délai devant s'écouler entre l'utilisation du sumatriptan et des médicaments contenant de l'ergotamine ou un autre triptan/agoniste du récepteur 5-HT1 n'est pas connu. Il dépendra aussi des doses et du type de produits à base d'ergotamine ou de tout autre triptan/agoniste du récepteur 5-HT1 utilisé. Les effets peuvent être additifs. Il est conseillé d'attendre au moins 24 heures après l'utilisation de médicaments contenant de l'ergotamine ou un autre triptan/agoniste du récepteur 5-HT1, avant l'administration du sumatriptan. Inversement, il est conseillé d'attendre au moins 6 heures après l'utilisation du sumatriptan, avant l'administration d'un médicament contenant de l'ergotamine et au moins 24 heures avant l'administration d'un autre triptan/agoniste du récepteur 5-HT1.Une interaction peut se produire entre le sumatriptan et les IMAO. L'administration concomitante de ces deux produits est donc contre-indiquée .
Après commercialisation, de rares cas de syndrome sérotoninergique (incluant une modification de l'état mental, des manifestations neurovégétatives et des troubles neuromusculaires) ont été décrits après utilisation concomitante d'un ISRS et du sumatriptan. Des cas de syndrome sérotoninergique ont également été rapportés après administration concomitante de triptans et d'IRSN .

 Français
Français Русский
Русский