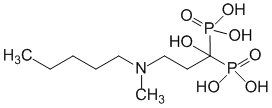
Pharmacodynamique
L'action pharmacodynamique de l'acide ibandronique consiste à inhiber la résorption osseuse. In vivo, l'acide ibandronique prévient la destruction osseuse provoquée expérimentalement par l'arrêt de la fonction gonadique, les rétinoïdes, les tumeurs ou les extraits de tumeurs.
Pharmacocinétique
Pharmacocinétique - ACIDE IBANDRONIQUE - voie orale
Les principaux effets pharmacologiques de l'acide ibandronique sur l'os ne sont pas directement liés aux concentrations plasmatiques observées, comme l'ont démontré diverses études réalisées chez l'animal et chez l'homme.
Absorption
L'absorption de l'acide ibandronique au niveau de la partie haute du tube digestif est rapide après administration orale et les concentrations plasmatiques augmentent de façon proportionnelle à la dose jusqu'à une prise orale de 50 mg ; au-delà de cette dose, les concentrations augmentent de façon plus importante que dose-dépendante.
Les concentrations plasmatiques maximales observées ont été atteintes en 0,5 à 2 heures (médiane 1 heure) chez le sujet à jeun et la biodisponibilité absolue a été d'environ 0,6 %. L'absorption est diminuée lorsque le produit est pris avec des aliments ou des boissons (autres que l'eau plate). La biodisponibilité est réduite d'environ 90 % quand l'acide ibandronique est administré avec un petit déjeuner standard, par comparaison à la biodisponibilité observée chez les sujets à jeun. La biodisponibilité n'est pas significativement réduite si l'acide ibandronique est pris 60 minutes avant la première absorption d'aliments de la journée. La biodisponibilité et les gains en termes de DMO sont réduits lorsque des aliments ou des boissons sont pris moins de 60 minutes après l'absorption orale de l'acide ibandronique.
Distribution
Après exposition systémique initiale, l'acide ibandronique se lie rapidement à l'os ou est excrété dans les urines. Chez l'homme, le volume de distribution terminal apparent est d'au moins 90 litres et la fraction de dose atteignant l'os est estimé à 40 - 50 % de la dose circulante. La liaison aux protéines plasmatiques est d'environ 85 % - 87 %(déterminée in vitro aux concentrations thérapeutiques), il existe donc un faible potentiel d'interactions médicamenteuses par déplacement.
Biotransformation
Aucun métabolisme de l'acide ibandronique n'a été mis en évidence, ni chez l'animal ni chez l'homme.
Elimination
La fraction absorbée de l'acide ibandronique est éliminée de la circulation par absorption osseuse (estimée à 40-50 % chez les femmes ménopausées), le reste étant éliminé sous forme inchangée par le rein. La fraction non absorbée de l'acide ibandronique est éliminée sous forme inchangée dans les fèces.
L'intervalle des demi-vies apparentes observées est large mais la demi-vie terminale apparente est généralement comprise entre 10 et 72 heures. Les valeurs calculées dépendant largement de la durée de l'étude, de la dose administrée et de la sensibilité de la méthode de dosage, la demi-vie terminale réelle est vraisemblablement beaucoup plus longue, comme pour les autres bisphosphonates. Les concentrations plasmatiques précoces baissent rapidement pour atteindre 10 % des concentrations maximales en l'espace respectivement de 3 et 8 heures après administration intraveineuse et orale. La clairance totale de l'acide ibandronique est faible, avec des valeurs moyennes comprises entre 84 et 160 ml/min. La clairance rénale (environ 60 ml/min chez des femmes ménopausées en bonne santé) représente 50 à 60 % de la clairance totale et est liée à la clairance de la créatinine. La différence entre la clairance totale apparente et la clairance rénale est censée refléter l'absorption osseuse.
Pharmacocinétique dans des situations cliniques particulières
Sexe
La biodisponibilité et la pharmacocinétique de l'acide ibandronique sont similaires chez l'homme et chez la femme.
Race
Aucune différence inter-ethnique cliniquement pertinente n'a été mise en évidence entre les Asiatiques et les Caucasiens en ce qui concerne la pharmacocinétique de l'acide ibandronique. Peu de données sont disponibles sur les patients d'origine africaine.
Insuffisants rénaux
La clairance rénale de l'acide ibandronique chez des patients présentant divers degrés d'insuffisance rénale est corrélée de façon linéaire à la clairance de la créatinine.
Comme observé lors de l'étude BM 16549 au cours de laquelle la majorité des patientes était atteinte d'insuffisance rénale légère à modérée, aucune adaptation de la posologie n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée (clairance de la créatinine supérieure ou égale à 30 ml/min).
Chez des insuffisants rénaux sévères (clairance de la créatinine inférieure à 30 ml/min) ayant reçu quotidiennement 10 mg d'acide ibandronique per os pendant 21 jours, les concentrations plasmatiques ont été 2 à 3 fois plus élevées que chez des sujets à fonction rénale normale et la clairance totale de l'acide ibandronique a été de 44 ml/min. Après administration intraveineuse de 0,5 mg, les valeurs de la clairance totale, de la clairance rénale et de la clairance non rénale ont été respectivement réduites de 67 %, 77 % et 50 % chez les insuffisants rénaux sévères, mais cette augmentation de l'exposition ne s'est pas accompagnée d'une réduction de la tolérance. En raison d'une expérience clinique limitée, l'administration d'acide ibandronique n'est pas recommandée en cas d'insuffisance rénale sévère . La pharmacocinétique de l'acide ibandronique n'a pas été évaluée chez des patients présentant une insuffisance rénale à un stade terminal traitée par d'autres moyens que l'hémodialyse. La pharmacocinétique de l'acide ibandronique chez ces patients étant inconnue, celui-ci ne doit pas être utilisé chez ces patients.
Insuffisants hépatiques
On ne dispose pas de données pharmacocinétiques concernant l'acide ibandronique chez l'insuffisant hépatique. Le foie ne joue aucun rôle significatif dans la clairance de l'acide ibandronique, qui n'est pas métabolisé mais éliminé par excrétion rénale et absorption osseuse. Par conséquent, aucune adaptation de la posologie n'est nécessaire chez l'insuffisant hépatique.
Personnes âgées
Dans une analyse multifactorielle, l'âge n'est apparu comme un facteur indépendant pour aucun des paramètres pharmacocinétiques étudiés. Comme la fonction rénale diminue avec l'âge, il s'agit du seul facteur à prendre en considération (voir le paragraphe sur l'insuffisance rénale).
Population pédiatrique
Il n'existe pas de données sur l'utilisation de ACIDE IBANDRONIQUE chez ces patients.
Pharmacocinétique - ACIDE IBANDRONIQUE - usage parentéral
Après une perfusion de 2 heures de 2, 4 et 6 mg, la pharmacocinétique de l'acide ibandronique est linéaire.
Distribution :Après passage systémique, l'acide ibandronique se lie rapidement à l'os ou est excrété dans les urines. Chez l'homme, le volume de distribution terminal apparent est d'au moins 90 litres et la fraction de dose atteignant l'os est estimée à 40-50 % de la dose circulante. La liaison aux protéines plasmatiques est d'environ 87 % aux doses thérapeutiques, et donc les interactions médicamenteuses par déplacement sont peu probables.
Biotransformation :Aucun métabolisme de l'acide ibandronique n'a été mis en évidence, ni chez l'animal ni chez l'homme.
Élimination :La fourchette des demi-vies apparentes observées est large et dépend de la dose et de la sensibilité de la méthode de dosage, mais la demi-vie terminale apparente est généralement comprise entre 10 et 60 heures. Toutefois, les concentrations plasmatiques précoces baissent rapidement pour atteindre 10 % des concentrations maximales en l'espace respectivement de 3 et 8 heures après administration intraveineuse et orale. Il n'a pas été observé d'accumulation systémique lorsque l'acide ibandronique a été administré par voie intraveineuse une fois toutes les 4 semaines pendant 48 semaines aux patients ayant des métastases osseuses.La clairance totale de l'acide ibandronique est faible, avec des valeurs moyennes comprises entre 84 et 160 ml/min. La clairance rénale (environ 60 ml/min chez des femmes ménopausées en bonne santé) représente 50 à 60 % de la clairance totale et elle est liée à la clairance de la créatinine. La différence entre la clairance totale apparente et la clairance rénale est censée refléter l'absorption osseuse.La voie de sécrétion ne semble pas inclure de systèmes de transport acides ou basiques connus impliqués dans l'excrétion d'autres substances actives. De plus, l'acide ibandronique n'inhibe pas les principales isoenzymes hépatiques humaines du cytochrome P450 et il n'est pas inducteur du système du cytochrome P450 hépatique chez le rat.
Pharmacocinétique chez les populations particulières :- Sexe : la biodisponibilité et la pharmacocinétique de l'acide ibandronique sont similaires chez l'homme et chez la femme.
- Race : aucune différence interethnique cliniquement pertinente n'a été mise en évidence entre les Asiatiques et les Caucasiens en ce qui concerne la pharmacocinétique de l'acide ibandronique. Très peu de données sont disponibles sur les patients d'origine africaine.
- Insuffisants rénaux : l'exposition à l'acide ibandronique chez des patients présentant divers degrés d'insuffisance rénale est corrélée à la clairance de la créatinine (Clcr). Chez les patients atteints d'insuffisance rénale sévère (Clcr moyenne estimée = 21,2 ml/min), l'AUC 0-24 h moyenne ajustée à la dose est augmentée de 110 % par rapport à celle des volontaires sains. Dans l'étude de pharmacocinétique WP18551, après administration par voie intraveineuse d'une dose unique de 6 mg (perfusion de 15 minutes), l'AUC 0-24 h moyenne a augmenté de 14 % et 86 % respectivement chez les patients présentant une insuffisance rénale légère (moyenne estimée Clcr = 68,1 ml/min) et modérée (moyenne estimée Clcr = 41,2 ml/min), comparé aux volontaires sains (moyenne estimée Clcr = 120 ml/min). La Cmax moyenne n'a pas augmenté chez les patients présentant une insuffisance rénale légère et a augmenté de 12 % chez les patients présentant une insuffisance rénale modérée.Aucune adaptation de posologie n'est nécessaire chez les patients présentant une insuffisance rénale légère (50 ≤ Clcr < 80 ml/min). Chez les patients présentant une insuffisance rénale modérée (30 ≤ Clcr < 50 ml/min) ou sévère (Clcr < 30 ml/min), et atteints de cancer du sein et de métastases osseuses, traités pour la prévention des complications osseuses, les recommandations de posologie doivent être suivies .
- Insuffisants hépatiques : on ne dispose pas de données pharmacocinétiques concernant l'acide ibandronique chez l'insuffisant hépatique. Le foie ne joue aucun rôle significatif dans la clairance de l'acide ibandronique, qui n'est pas métabolisé mais éliminé de la circulation par excrétion rénale et absorption osseuse. Par conséquent, aucune modification de la posologie n'est nécessaire chez l'insuffisant hépatique. De plus, comme la liaison de l'acide ibandronique aux protéines plasmatiques est approximativement de 87 % aux doses thérapeutiques, l'hypoprotéinémie chez les insuffisants hépatiques sévères est peu susceptible de conduire à des augmentations de la fraction libre plasmatique cliniquement significatives.
- Personnes âgées : dans une analyse multifactorielle, l'âge n'est apparu comme un facteur indépendant pour aucun des paramètres pharmacocinétiques étudiés. Comme la fonction rénale diminue avec l'âge, il s'agit du seul facteur à prendre en considération .
- Population pédiatrique : on ne dispose pas de données sur l'utilisation de ACIDE IBANDRONIQUE chez les patients de moins de 18 ans.
Dosage
Dosage - ACIDE IBANDRONIQUE - voie orale
Comprimé pelliculé
La posologie recommandée est de 1 comprimé pelliculé à 150 mg une fois par mois.
Il est préconisé de toujours prendre le comprimé à la même date chaque mois.
ACIDE IBANDRONIQUE doit être pris le matin à jeun (après un jeûne d'au moins 6 heures) et 1 heure avant la première prise d'aliments ou de boissons (autre que l'eau) de la journée ou la prise de tout autre médicament ou supplément (y compris le calcium) par voie orale.
En cas d'oubli de la dose mensuelle, il faut avertir la patiente de prendre un comprimé de ACIDE IBANDRONIQUE 150 mg le lendemain matin du jour où l'oubli est constaté, sauf si l'intervalle avant la prise suivante est de moins d'une semaine. La patiente reviendra ensuite à son rythme mensuel d'administration, aux dates initialement prévues.
Si l'intervalle avant la prise suivante est de moins d'une semaine, la patiente attendra la date de la prise suivante puis poursuivra son rythme mensuel d'administration, aux dates prévues.
La patiente ne doit pas prendre deux comprimés la même semaine.
Les patientes doivent être supplémentées en calcium et/ou en vitamine D si leurs apports alimentaires sont insuffisants .
La durée optimale du traitement par bisphosphonates pour l'ostéoporose n'a pas été établie. La nécessité de poursuivre le traitement doit être réévaluée régulièrement au cas par cas en fonction des bénéfices et des risques potentiels de l'acide ibandronique, particulièrement après 5 ans ou plus de traitement.
Populations particulières
Insuffisants rénaux
En raison d'une expérience clinique limitée, l'utilisation d'ACIDE IBANDRONIQUE n'est pas recommandée chez les patientes présentant une clairance de la créatinine inférieure à 30 ml/min .
Aucune adaptation de la posologie n'est nécessaire chez les patientes présentant une insuffisance rénale légère ou modérée, caractérisée par une clairance de la créatinine supérieure ou égale à 30 ml/min.
Insuffisants hépatiques
Aucune adaptation de la posologie n'est nécessaire .
Personnes âgées (> 65 ans)
Aucune adaptation de la posologie n'est nécessaire .
Population pédiatrique
Il n'y a pas d'utilisation spécifique d'acide ibandronique chez l'enfant de moins de 18 ans, et l'acide ibandronique n'a pas été étudié dans cette population .
Mode d'administration
Voie orale.
Les comprimés doivent être avalés entiers avec un verre d'eau (180 à 240 ml d'eau du robinet ou eau faiblement minéralisée), la patiente se tenant droite, en position assise ou debout. Une eau avec une forte concentration en calcium ne doit pas être utilisée. En cas de doute sur un niveau potentiellement élevé de calcium dans l'eau du robinet (eau calcaire), il est conseillé d'utiliser de l'eau en bouteille faiblement minéralisée.
Les patientes ne doivent pas s'allonger pendant l'heure qui suit la prise d'acide ibandronique
L'eau est la seule boisson pouvant être prise avec l'acide ibandronique.
Les patientes ne doivent pas mâcher ou sucer le comprimé en raison du risque potentiel d'ulcérations oropharyngées.
Dosage - ACIDE IBANDRONIQUE - usage parentéral
Solution injectable
La posologie recommandée d'acide ibandronique est de 3 mg, administrée par une injection intraveineuse en 15 à 30 secondes, tous les 3 mois.
Les patientes doivent être supplémentées en calcium et en vitamine D .
En cas d'oubli, l'injection doit être pratiquée dès que possible. Les injections suivantes devront ensuite être planifiées tous les 3 mois à compter de la date de la dernière injection.
La durée optimale du traitement par bisphosphonates pour l'ostéoporose n'a pas été établie. La nécessité de poursuivre le traitement doit être réévaluée régulièrement au cas par cas en fonction des bénéfices et des risques potentiels de ACIDE IBANDRONIQUE 3 mg, solution injectable en seringue pré-remplie, particulièrement après 5 ans ou plus de traitement.
Populations particulières
Insuffisants rénaux
Aucune adaptation de la posologie n'est nécessaire chez les patientes présentant une insuffisance rénale légère ou modérée, caractérisée par une créatinine sérique inférieure ou égale à 200 µmol/l (2,3 mg/dl) ou par une clairance de la créatinine (mesurée ou estimée) supérieure ou égale à 30 ml/min.
En raison de données limitées chez ces patientes lors des études cliniques, l'utilisation de ACIDE IBANDRONIQUE 3 mg, solution injectable en seringue pré-remplie n'est pas recommandée chez les patientes présentant une créatinine sérique supérieure à 200 µmol/l (2,3 mg/dl) ou une clairance de la créatinine (mesurée ou estimée) inférieure à 30 ml/min .
Insuffisants hépatiques
Aucune adaptation de la posologie n'est nécessaire .
Personnes âgées
Aucune adaptation de la posologie n'est nécessaire .
Population pédiatrique
Il n'y a pas d'utilisation spécifique d'ACIDE IBANDRONIQUE chez l'enfant, et ACIDE IBANDRONIQUE n'a pas été étudié en pédiatrie.
Mode d'administration
Voie intraveineuse.
Respecter strictement l'administration par voie intraveineuse .
Solution à diluer pour perfusion
Le traitement par ACIDE IBANDRONIQUE doit être initié seulement par des médecins ayant l'expérience de la prise en charge des cancers.
Posologie
Prévention des complications osseuses chez les patients atteints de cancer du sein et de métastases osseuses
La dose recommandée pour la prévention des complications osseuses chez les patients atteints de cancer du sein et de métastases osseuses est de 6 mg par voie intraveineuse administré toutes les 3-4 semaines. La dose doit être perfusée pendant au moins 15 minutes. Pour la perfusion, le contenu de(s) flacon(s) doit être ajouté uniquement à 100 ml de solution isotonique de chlorure de sodium ou 100 ml de solution de glucose à 5 %.
Une durée de perfusion plus courte (c'est-à-dire 15 minutes) doit être pratiquée uniquement chez les patients présentant une fonction rénale normale ou une insuffisance rénale légère. Il n'y a pas de donnée disponible décrivant l'utilisation d'une durée de perfusion plus courte chez les patients ayant une clairance de la créatinine inférieure à 50 ml/min. Les prescripteurs doivent se référer au paragraphe « Insuffisants rénaux » pour connaître les recommandations sur la posologie et l'administration d'ACIDE IBANDRONIQUE chez ces patients.
Traitement de l'hypercalcémie induite par des tumeurs
Avant le traitement par ACIDE IBANDRONIQUE, le patient doit être correctement hydraté au besoin avec du chlorure de sodium à 9 mg/ml (0,9 %). La sévérité de l'hypercalcémie et le type de tumeur doivent être pris en compte.
En général, les patients présentant des métastases osseuses ostéolytiques nécessitent des doses inférieures à celles des patients présentant une hypercalcémie d'origine humorale.
Chez la plupart des patients ayant une hypercalcémie sévère (calcémie corrigée en fonction de l'albumine* ≥ 3 mmol/l ou ≥ 12 mg/dl), la posologie est de 4 mg en dose unique. Chez les patients ayant une hypercalcémie modérée (calcémie corrigée en fonction de l'albumine < 3 mmol/l ou < 12 mg/dl), la posologie efficace est de 2 mg. La posologie la plus élevée utilisée au cours des essais cliniques était de 6 mg, mais cette posologie n'apporte pas de bénéfice supplémentaire en termes d'efficacité.
*Remarque : la calcémie corrigée en fonction de l'albumine est calculée comme suit :
Pour convertir la calcémie corrigée en fonction de l'albumine de mmol/l en mg/dl, multiplier par 4.
Dans la plupart des cas, une calcémie élevée peut être ramenée à la normale en l'espace de 7 jours. Le délai médian de rechute (retour de la calcémie corrigée en fonction de l'albumine à une valeur supérieure à 3 mmol/l) était de 18 à 19 jours aux doses de 2 et 4 mg. Le délai médian de rechute était de 26 jours pour une dose de 6 mg.
Un nombre limité de patients (50 patients) a reçu une seconde perfusion pour hypercalcémie. En cas d'hypercalcémie récidivante ou d'efficacité insuffisante, il est possible de renouveler le traitement.
Insuffisants hépatiques
Aucune modification de la posologie n'est nécessaire .
Insuffisants rénaux
Aucune adaptation de la posologie n'est nécessaire chez les patients présentant une insuffisance rénale légère (50 ≤ CLcr < 80 mL/min). Chez les patients présentant une insuffisance rénale modérée (30 ≤ CLcr < 50 mL/min) ou sévère (CLcr < 30 mL/min), et atteints d'un cancer du sein et de métastases osseuses, traités pour la prévention des complications osseuses, les recommandations de posologie décrites ci-dessous doivent être suivies .
1 Administration toutes les 3-4 semaines
2 Solution de chlorure de sodium à 0,9 % ou solution de glucose à 5 %
Une durée de perfusion de 15 minutes n'a pas été étudiée chez les patients atteints d'un cancer avec une clairance de la créatinine < 50 ml/min.
Personnes âgées
Aucune modification de la posologie n'est nécessaire.
Population pédiatrique
La tolérance et l'efficacité d'ACIDE IBANDRONIQUE chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
Voie intraveineuse.
A usage unique. Seule une solution limpide exempte de particules doit être utilisée.
ACIDE IBANDRONIQUE 2 mg, solution à diluer pour perfusion doit être administré en perfusion intraveineuse. A cette fin, le contenu des flacons doit être ajouté à 500 ml de solution isotonique de chlorure de sodium (ou 500 ml de solution de glucose à 5 %), le mélange devant être perfusé en l'espace de 2 heures.
L'administration accidentelle par voie intra-artérielle de préparations non expressément destinées à cette voie de même qu'une administration péri-veineuse étant susceptibles de causer des lésions tissulaires, il faut veiller à administrer ACIDE IBANDRONIQUE 2 mg, solution à diluer pour perfusion par voie intraveineuse.
Indications
Indications - ACIDE IBANDRONIQUE - usage systémique
Traitement de l'ostéoporose post-ménopausique chez la femme à risque augmenté de fracture .
Une réduction du risque de fractures vertébrales a été démontrée, l'efficacité sur les fractures du col du fémur n'a pas été établie.
Contre-indications
Hypocalcémie.
Anomalies de l'oesophage ralentissant le transit oesophagien, telles qu'une sténose ou une achalasie.
Incapacité à rester en position droite (assise ou debout) pendant au moins 60 minutes.
Effets indésirables
Effets indésirables - ACIDE IBANDRONIQUE - usage systémique
La tolérance d'un traitement oral par de l'acide ibandronique 2,5 mg une fois par jour a été évaluée chez 1251 patientes incluses dans 4 études cliniques contrôlées versus placebo, dont 73 % d'entre elles dans l'étude pivot de trois ans (MF 4411). Dans toutes ces études, le profil général de tolérance de l'acide ibandronique 2,5 mg une fois par jour a été similaire à celui du placebo. Dans l'étude pivot MF 4411, le pourcentage de patientes ayant présenté un effet indésirable (un événement indésirable dont la relation de causalité au médicament à l'essai a été considérée comme possible ou probable) a été de 19,8 % sous acide ibandronique et de 17,9 % sous placebo.
Dans l'étude BM 16549, étude effectuée sur deux ans dans l'ostéoporose post-ménopausique, la tolérance globale de l'acide ibandronique 150 mg une fois par mois a été similaire à celle de l'acide ibandronique 2,5 mg une fois par jour. Le pourcentage de patientes ayant présenté un effet indésirable a été respectivement à un an et deux ans de 22,7 % et 25,0 % sous acide ibandronique 150 mg une fois par mois et de 21,5 % et 22,5 % sous acide ibandronique 2,5 mg une fois par jour. La majorité des effets indésirables a été d'intensité légère à modérée. Dans la plupart des cas, ces effets n'ont pas entraîné l'arrêt du traitement.
L'effet indésirable le plus fréquemment rapporté a été une arthralgie.
Les fréquences sont définies comme suit : fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000) et très rare (< 1/10 000). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1 : Effets indésirables rapportés chez les femmes ménopausées traitées par l'acide ibandronique 150 mg une fois par mois ou par l'acide ibandronique 2,5 mg une fois par jour dans les études de phase III BM 16549 et MF 4411 et depuis la commercialisation.
Système organe classe | Fréquent | Peu fréquent | Rare | Très rare |
Affections du système immunitaire | | | Réactions d'hypersensibilité. | |
Affections du système nerveux | Céphalées. | Sensation vertigineuse. | | |
Affections oculaires | | | Inflammation oculaire*. | |
Affections gastro-intestinales* | sophagite, gastrite, reflux gastro-sophagien, dyspepsie, diarrhées, douleurs abdominales, nausées. | sophagites incluant ulcérations ou sténoses de l'sophage et dysphagie, vomissements, flatulences. | Duodénite. | |
Affections de la peau et du tissu sous-cutané | Eruption cutanée. | | Angio-dème, dème de la face, urticaire. | |
Affections musculo-squelettiques et systémiques | Arthralgies, myalgies, douleurs musculo-squelettiques, crampe musculaire, raideur musculaire. | Douleurs dorsales. | Fractures fémorales atypiques sous-trochantériennes et diaphysaires (effets indésirables de classe des bisphosphonates). | Ostéo-nécrose de la mâchoire*. |
Troubles généraux et anomalies au site d'administration | Syndrome pseudo-grippal*. | Fatigue. | | |
* Se reporter aux informations complémentaires ci-dessous
identifié depuis la commercialisation
Affections gastro-intestinales
L'étude conduite avec ce médicament une fois par mois a inclus des patientes ayant des antécédents digestifs notamment ulcère gastroduodénal sans hémorragie ou hospitalisation récentes, ainsi que des patients ayant une dyspepsie ou un reflux contrôlés par un traitement. Chez ces patientes, il n'y a pas eu de différence d'incidence des effets indésirables digestifs hauts entre les deux schémas posologiques, 150 mg une fois par mois et 2,5 mg une fois par jour.
Syndrome pseudo-grippal
Des symptômes pseudo-grippaux transitoires ont été rapportés avec l'acide ibandronique 150 mg une fois par mois, habituellement lors de la première administration. Ces symptômes ont généralement été de courte durée, d'intensité légère à modérée et ont disparu lors de la poursuite du traitement sans nécessiter de mesures particulières. Le syndrome pseudo-grippal inclut des effets tels que myalgies, arthralgies, fièvre, frissons, fatigue, nausées, perte d'appétit ou douleurs osseuses.
Ostéonécrose de la mâchoire
Une ostéonécrose de la mâchoire a été rapportée chez des patients traités par bisphosphonates. La majorité des cas rapportés concernait des patients atteints de cancer, néanmoins certains de ces cas ont été également rapportés chez des patients traités pour ostéoporose. L'ostéonécrose de la mâchoire est généralement associée à une extraction dentaire et/ou à une infection locale (y compris une ostéomyélite). Sont considérés également comme facteurs de risque un diagnostic de cancer, une chimiothérapie, une radiothérapie, une corticothérapie et une mauvaise hygiène buccale .
Inflammation oculaire
Des cas d'inflammation oculaire tels qu'uvéite, épisclérite et sclérite ont été rapportés avec l'acide ibandronique. Dans certains cas, ces événements ne se sont résolus qu'à l'arrêt du traitement par l'acide ibandronique.
D'après les données de commercialisation les réactions suivantes ont été rapportées (fréquence rare) : fractures fémorales atypiques sous-trochantériennes et diaphysaires (effet indésirable des bisphophonates).
Surdosage
On ne dispose pas d'informations spécifiques sur la conduite à tenir en cas de surdosage par ACIDE IBANDRONIQUE. D'après les connaissances acquises sur cette classe médicamenteuse, un surdosage par voie intraveineuse peut conduire à une hypocalcémie, une hypophosphatémie et une hypomagnésémie. Des réductions cliniquement significatives des taux de calcium, phosphore et magnésium doivent être corrigées respectivement par une administration intraveineuse de gluconate de calcium, potassium ou phosphate de sodium, et sulfate de magnésium
Grossesse/Allaitement
Grossesse
Il n'existe pas de données suffisantes sur l'administration de l'acide ibandronique chez la femme enceinte. Les études chez le rat ont révélé une toxicité sur la reproduction . Le risque potentiel chez l'homme est inconnu.
ACIDE IBANDRONIQUE ne doit pas être utilisé pendant la grossesse.
Allaitement
Le passage de l'acide ibandronique dans le lait maternel n'est pas connu. Les études menées chez des rates allaitant ont démontré la présence de faibles quantités d'acide ibandronique dans le lait après administration intraveineuse.
ACIDE IBANDRONIQUE ne doit pas être utilisé pendant l'allaitement.
Fécondité
Il n'existe pas de données sur les effets de l'acide ibandronique chez l'homme. Lors des études de reproduction menées chez le rat par voie orale, l'acide ibandronique a diminué la fécondité. Lors des études menées chez le rat par voie intraveineuse, l'acide ibandronique a diminué la fécondité à des doses quotidiennes élevées .
Interactions avec d'autres médicaments
Les interactions métaboliques sont jugées improbables dans la mesure où l'acide ibandronique n'inhibe pas les principales isoenzymes hépatiques humaines du cytochrome P450 et où il ne s'est pas révélé non plus inducteur du système du cytochrome P450 hépatique chez le rat. En outre, la liaison aux protéines plasmatiques est d'environ 85 % - 87 % (déterminée in vitro aux concentrations thérapeutiques), il existe donc un faible potentiel d'interactions médicamenteuses par déplacement. L'acide ibandronique est éliminé uniquement par excrétion rénale et il ne subit aucune biotransformation. La voie de sécrétion ne semble pas inclure de systèmes de transport acides ou basiques connus pour être impliqués dans l'excrétion d'autres substances actives.
Les études d'interactions pharmacocinétiques réalisées chez des femmes ménopausées ont démontré l'absence de toute interaction potentielle avec le tamoxifène ou l'hormonothérapie substitutive (estrogènes).
Aucune interaction n'a été observée lors de l'utilisation concomitante de melphalan et de prednisolone chez des patients atteints de myélome multiple.

 Français
Français Русский
Русский