Pharmacodynamique
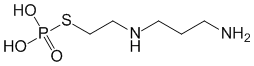
Ethyol (amifostine ; éthanethiol, 2-[(3-amino propyl)amino]-dihydrogène phosphate (ester)) est un thiophosphate organique qui, dans les modèles animaux, protège sélectivement les tissus sains mais non les tumeurs contre la cytotoxicité des radiations ionisantes, des agents de chimiothérapie ayant pour cible l'ADN (agents alkylants classiques tels que le cyclophosphamide et non classiques tels que la mitomycine-C) et les analogues au platine.
Ethyol est une prodrogue qui est déphosphorylée en son métabolite actif, le WR‑1065 (thiol libre), par la phosphatase alcaline et qui quitte rapidement la circulation sanguine.
La diminution des taux du calcium sérique constitue un effet pharmacologique connu d'Ethyol.
Études cliniques
Chimiothérapie pour le cancer de l'ovaire
Une étude randomisée et contrôlée a comparé six cycles de cyclophosphamide 1000 mg/m2, et de cisplatine 100 mg/m2 avec ou sans prétraitement par l'Ethyol 910 mg/m2. Après des cures multiples de chimiothérapie, un prétraitement (CP) avec l'Ethyol a réduit considérablement la toxicité rénale cumulative associée à la cisplatine, évaluée par la proportion de patients qui présentaient une réduction ≥ 40 % de la clairance de la créatinine d'après les résultats du prétraitement, des élévations prolongées de la créatininémie (> 1,5 mg/dl), ou une hypomagnésémie grave. Les analyses choisies des effets de l'Ethyol sur la réduction de la toxicité rénale cumulative due à la cisplatine lors d'une étude randomisée sur le cancer de l'ovaire sont présentées dans les tableaux ci-dessous.
Proportion de patients présentant une réduction ≥ 40 % de la clairance de la créatinine calculée*
| Ethyol + CP | CP | Valeur p (bilatérale) |
Tous les patients | 16/122 (13 %) | 36/120 (30 %) | 0,001 |
*Les valeurs de la clairance de la créatinine ont été calculées à l'aide de la formule de Cockcroft-Gault, Nephron 1976 ; 16 :31-41.
Grades de toxicité NCI relatifs aux niveaux de magnésium sérique pour la dernière cure de chaque patient
Grade NCI- | 0 | 1 | 2 | 3 | 4 | Valeur p* |
CTC : (mEq/L) | > 1,4 | ≤ 1,4- > 1,1 | ≤ 1,1- > 0,8 | ≤ 0,8- > 0,5 | ≤ 0,5 | |
Tous les patients | | | | | | 0.001 |
Ethyol+CP | 92 | 13 | 3 | 0 | 0 | |
CP | 73 | 18 | 7 | 5 | 1 | |
*selon la statistique du chi carré de Mantel-Haenszel (test bilatéral)
Il a été constaté qu'un prétraitement par l'amifostine (910 mg/m2) protège contre la toxicité hématologique cumulative associée à la combinaison cisplatine (100 mg/m2) et cyclophosphamide (1000 mg/m2) lors du traitement du cancer de l'ovaire de stades III et IV. L'incidence de la neutropénie de grade 4 associée à de la fièvre et/ou des infections était le critère d'évaluation principal utilisé pour évaluer la toxicité hématologique. L'incidence totale de neutropénie par patient, associée à de la fièvre et/ou des signes et symptômes d'infections nécessitant un traitement par des antibiotiques après 6 cures à des intervalles de 3 semaines dans l'ensemble des 242 patients est présentée dans le tableau ci-dessous.
Incidence de la neutropénie associée à de la fièvre et/ou un signe d'infection nécessitant un traitement par des antibiotiques
| Ethyol + CP | CP | Valeur p* |
Incidence totale par patient | 8/122 | 26/120 | 0,001 |
*selon la statistique du chi carré de Mantel-Haenszel (test bilatéral)
La conservation de l'efficacité antitumorale d'une chimiothérapie à base de cisplatine et de cyclophosphamide a été évaluée grâce aux données de la réponse tumorale. Les résultats démontrent que l'amifostine ne réduit pas l'efficacité antitumorale de la chimiothérapie à base de cisplatine et de cyclophosphamide.
Radiothérapie pour le cancer de la tête et du cou
Une étude randomisée et contrôlée de rayonnement fractionné (RT) standard (1,8 Gy 2,0 Gy/jour pendant 5 jours/semaine pendant 5-7 semaines) avec ou sans Ethyol, administré à raison de 200 mg/m2 sous forme de perfusion iv pendant 3 minutes, 15-30 minutes avant chaque fraction de rayonnement, a été réalisée avec 315 patients souffrant d'un cancer de la tête et du cou. Les critères d'efficacité primaires de cette étude pour évaluer les toxicités associées au rayonnement sur la région de la tête et du cou, étaient l'incidence d'une xérostomie aiguë de grade 2 ou plus (survenue ≤ 90 jours à compter du début de la radiothérapie) et tardive (survenue 1 an après le début de la radiothérapie), et l'incidence d'une mucosite aiguë de grade 3 ou plus. L'incidence de la xérostomie aiguë et tardive de grade 2 ou plus a été considérablement réduite (voir le tableau ci-dessous). Bien que l'incidence de la mucosite de grade 3 ou plus était moindre dans le bras recevant de l'amifostine, la différence entre les deux bras de traitement n'était pas statistiquement significative.
Incidence de la xérostomie de grade 2 ou plus (critères RTOG)
| Ethyol + RT | RT | Valeur p* |
Aiguë (survenue ≤ 90 jours après le début de la radiothérapie) | 51 % (75/148) | 78 % (120/153) | p < 0,0001 |
Tardive (survenue 1 an après le début de la radiothérapie) | 34 % (33/97) | 57 % (60/106) | p = 0,0019 |
*d'après le test exact de Fisher.
Le paramètre principal pour évaluer l'efficacité antitumorale a été l'incidence du contrôle loco-régional à 1 an. Le contrôle loco-régional, la survie sans maladie et la survie globale étaient comparables dans les deux groupes de traitement après une année de suivi.
Pharmacocinétique
Pharmacocinétique - AMIFOSTINE - usage parentéral
Les études de pharmacocinétique clinique ont montré que l'amifostine est rapidement éliminée du plasma avec < 10 % restant dans le plasma 6 minutes après l'administration du médicament. L'amifostine est rapidement métabolisée en son métabolite actif, le WR-1065 (thiol libre). Le WR‑33278 (disulfide) est le métabolite inactif suivant. On ne sait pas si l'amifostine franchit la barrière placentaire.
Après une perfusion en 15 minutes d'une dose de 910 mg/m², la demi-vie a est < 1 minute, la demi‑vie d'élimination de l'amifostine est < 10 minutes.
Au cours d'une perfusion en 15 minutes d'une dose de 910 mg/m² d'amifostine, la concentration maximale dans le plasma est d'environ 200 µmol/l, le Vdss est 7 litres et la clairance est de 2 litres/min. La concentration maximale dans le plasma du métabolite actif WR‑1065 durant une perfusion de 15 minutes est d'environ 35 µmol/l. La mesure du WR-1065 dans les cellules de la moelle osseuse 5‑8 minutes après la perfusion chez 3 malades était de 82, 121 et 227 µmol/kg.
Le principal mécanisme de clairance d'AMIFOSTINE s'effectue par métabolisme, plutôt que par élimination rénale et gastro-intestinale. Après une perfusion intraveineuse de 740 mg/m² d'AMIFOSTINE de 15 minutes, l'excrétion rénale de la molécule mère et de ses deux métabolites connus était faible dans l'heure qui suivait l'administration du produit, de l'ordre de 1,05 %, 1,38 %, et 4,2 % de la dose administrée respectivement pour la molécule mère, le dérivé thiol, et le disulfide.
Dosage
Dosage - AMIFOSTINE - usage parentéral
Poudre pour solution pour perfusion
Chimiothérapie :
Chez les patientes atteintes de carcinome ovarien avancé recevant un traitement associant cisplatine et cyclophosphamide, la dose initiale recommandée d'AMIFOSTINE est de 910 mg/m² administrée une fois par jour sous forme d'une seule perfusion IV de 15 minutes débutant dans les 30 minutes qui précèdent la chimiothérapie à base de produits administrés en perfusion courte.
Lorsqu'AMIFOSTINE est administré dans le but de réduire la néphrotoxicité associée au cisplatine, la dose initiale recommandée d'AMIFOSTINE est alors fonction de la dose de cisplatine et de son schéma d'administration. Pour des doses de cisplatine de 100‑120 mg/m², la dose initiale recommandée d'AMIFOSTINE est de 910 mg/m² administrée en perfusion d'un maximum 15 minutes débutant dans les 30 minutes qui précèdent la chimiothérapie. Si la dose de cisplatine est inférieure à 100 mg/m², mais supérieure ou égale à 60 mg/m2, la dose initiale recommandée d'AMIFOSTINE est de 740 mg/m² administrée en perfusion intraveineuse d'un maximum 15 minutes débutant dans les 30 minutes qui précèdent la chimiothérapie. Une perfusion en 15 minutes pour des doses de 740-910 mg/m2 est semble-t-il mieux tolérée qu'une perfusion de plus longue durée. Des temps de perfusion plus courts n'ont pas été évalués de manière systématique avec les traitements de chimiothérapie.
Il est nécessaire de surveiller la tension artérielle pendant la perfusion d'AMIFOSTINE.
La perfusion d'AMIFOSTINE doit être interrompue si la tension artérielle systolique décroît de façon significative par rapport à sa valeur initiale, selon les recommandations suivantes :
Recommandations en vue de l'interruption de la perfusion d'AMIFOSTINE
en cas de baisse de la tension artérielle systolique
| Tension systolique initiale (mm de Hg) |
| < 100 | 100-119 | 120-139 | 140-179 | ³ 180 |
Baisse de la tension systolique durant la perfusion d'AMIFOSTINE (mm de Hg) | 20 | 25 | 30 | 40 | 50 |
Si la tension artérielle redevient normale dans les 5 minutes et si le malade est asymptomatique, on peut recommencer la perfusion afin que la totalité de la dose prescrite d'AMIFOSTINE soit administrée. Si on ne peut pas administrer la dose totale d'AMIFOSTINE, il y aura lieu, lors des chimiothérapies ultérieures, de réduire la dose d'AMIFOSTINE d'environ 20 %. Par exemple, la dose de 910 mg/m2 doit être réduite à 740 mg/m².
Radiothérapie :
Lorsqu'AMIFOSTINE est destiné à la prévention des toxicités associées à la radiothérapie, la dose quotidienne recommandée d'AMIFOSTINE est de 200 mg/m2 administrée en perfusion IV de 3 minutes débutant dans les 15 à 30 minutes avant la séance de radiothérapie standard fractionnée.
Il est nécessaire de surveiller la tension artérielle avant et après la perfusion .
Populations particulières
Population pédiatrique
La sécurité et l'efficacité d'AMIFOSTINE chez les enfants n'ont pas été établies. En conséquence, l'utilisation d'AMIFOSTINE n'est pas recommandée dans la population pédiatrique.
Patients âgés
La nécessité d'ajuster les doses chez les patients âgés n'a pas été étudiée, en conséquence, l'utilisation d'AMIFOSTINE n'est pas recommandée chez ces patients.
Insuffisance rénale et hépatique
Aucune donnée n'est disponible ; l'utilisation d'AMIFOSTINE n'est pas recommandée.
Mode d'administration
Administration intraveineuse.
Précautions à prendre avant la manipulation ou l'administration du médicament
Le produit reconstitué doit être inspecté visuellement pour détecter la présence de particules ou de signe de changement de couleur avant administration chaque fois que la solution et le conditionnement le permettent. Ne pas utiliser si un trouble ou un précipité est observé. AMIFOSTINE ne doit être utilisé que sous la surveillance de médecins ayant l'expérience de la chimiothérapie anticancéreuse ou de la radiothérapie.
Indications
Indications - AMIFOSTINE - usage systémique
Chimiothérapie
Prévention du risque de neutropénie et de ses conséquences (en particulier les infections) due à l'utilisation combinée de cyclophosphamide et de cisplatine chez des patientes atteintes de carcinome ovarien avancé (FIGO stade III ou IV).
Prévention de la néphrotoxicité cumulative du cisplatine et des traitements contenant du cisplatine, lorsque les doses unitaires de celui-ci sont comprises entre 60 et 120 mg/m², en association à des mesures d'hydratation adéquates chez les patients présentant des tumeurs solides avancées non germinales.
Radiothérapie
Prévention des xérostomies aiguës et tardives dans les cancers ORL, en association avec une radiothérapie fractionnée standard. Le rapport bénéfice/risque d'Ethyol en association avec la radiothérapie de conformation avec modulation d'intensité n'a pas été établi.
Contre-indications
Hypersensibilité à l'amifostine ou aux aminothiols. Les patients hypotendus ou déshydratés ne doivent pas recevoir Ethyol.
Surdosage
Lors des études de phase I, la dose unique maximale d'Ethyol administrée était de 1.300 mg/m². Il n'existe aucune information sur des doses plus élevées chez l'adulte. Dans le cadre d'études cliniques, des enfants ont reçu des doses allant jusqu'à 2,7 g/m² sans effet indésirable. Des doses multiples (jusqu'à trois fois la dose unique recommandée de 740-910 mg/m2) ont été administrées sans risque sur une période de 24 heures au cours d'études. Après une administration réitérée d'Ethyol 2 et 4 heures après la dose initiale, il n'y a pas eu de preuve d'effets indésirables augmentés ou cumulatifs, particulièrement nausées et vomissements ou hypotension. Le symptôme de surdosage le plus probable devrait être l'hypotension qui peut être contrôlée par une perfusion de sérum physiologique ou tout autre traitement symptomatique. La DL50 chez les souris se situe entre 554 mg/kg et 1140 mg/kg.
Grossesse/Allaitement
Grossesse et femmes en âge de procréer
Il n'y a pas suffisamment de données sur l'utilisation d'Ethyol chez les femmes enceintes. Dans la mesure où ce médicament est administré avec des traitements connus pour être tératogènes, il n'est pas recommandé au cours de la grossesse et chez les femmes en âge de procréer n'utilisant pas de méthode contraceptive.
Allaitement
On ne sait pas si l'amifostine ou ses métabolites sont excrétés dans le lait maternel humain. Il n'est pas possible d'exclure un risque pour les nouveau-nés/nourrissons. Par ailleurs, puisque Ethyol doit être administré conjointement à des médicaments qui sont connus pour être tétarogènes et mutagènes, il est recommandé d'interrompre l'allaitement avant de commencer un traitement avec Ethyol.
Fertilité
Les études chez l'animal ont montré une dégénérescence bilatérale de l'épithélium germinal des testicules et une hypospermie bilatérale dans l'épididyme . Le risque potentiel pour l'homme n'est pas connu.
Interactions avec d'autres médicaments
Il n'existe que peu de données quant au risque d'interaction. La clairance plasmatique rapide de l'amifostine minimise le risque d'interactions entre l'amifostine et d'autres médicaments.
Une attention particulière est nécessaire en cas d'administration concomitante d'Ethyol et d'antihypertenseurs ou d'autres médicaments susceptibles de potentialiser une hypotension.
Aucune étude d'interaction spécifique n'a été réalisée chez les patients recevant Ethyol et une radiothérapie.

 Français
Français Русский
Русский