En raison des faibles concentrations administrées, on ne s'attend pas à des effets pharmacodynamiques du bicisate (99mTc).
Pharmacocinétique - BICISATE - usage parentéral
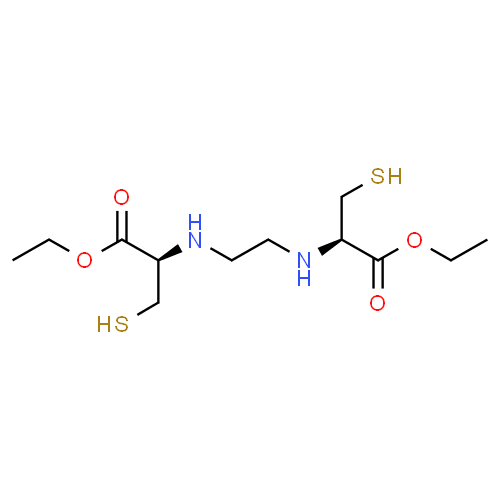
Après reconstitution du trousse de BICISATE par addition du pertechnétate (99mTc) de sodium, il se forme le complexe Tc-99m N,N'(1,2-éthylènediyl)bis-L-cystéine diéthyl ester bicisate (99mTc).
Le bicisate (99mTc) peut exister sous quatre formes énantiomères différentes en fonction de la stéréochimie de la configuration du bicisate. Des études ont démontré que seul le dérivé L,L est retenu et métabolisé par l'encéphale de façon stéréo-sélective. A l'opposé, le complexe 99mTc dérivé de l'isomère D,D traverse la barrière hémato-encéphalique et est extrait par le cerveau, mais il n'est ni fixé, ni métabolisé dans des proportions appréciables. C'est pourquoi, seule la forme L,L est présente dans le BICISATE .
Des études conduites chez le volontaire sain ont montré que la fixation initiale du bicisate (99mTc) par le cerveau est de 4,8 à 6,5% de l'activité administrée, quelques minutes seulement après l'injection. La fixation et la rétention du bicisate (99mTc) par le cerveau sont suffisantes pour permettre d'obtenir une image en tomoscintigraphie par émission monophotonique (TEMP) immédiatement après administration. Le bicisate (99mTc) s'élimine très lentement du cerveau. Sa répartition dans l'encéphale reste stable pendant au moins six heures après l'injection. Cette répartition est comparable à celle observée avec le xénon-133, produit de référence pour l'étude du débit sanguin cérébral.
Le bicisate (99mTc) s'élimine rapidement du sang circulant. Une heure après administration, il reste dans le sang moins de 5% de l'activité injectée. Cinq minutes après injection, la plus grande partie de l'activité du sang veineux est due à la présence de métabolites. En moyenne, 74% de l'activité administrée sont excrétés dans les urines au cours des premières 24 heures suivant l'injection et jusqu'à 50% dans les deux premières heures.
Etant donné que la paroi vésicale est l'organe critique en terme d'irradiation et que l'élimination urinaire du bicisate (99mTc) est rapide, il est possible de réduire la dose délivrée en augmentant la fréquence des mictions. Ni le bicisate (99mTc), ni ses métabolites ne sont liés aux protéines plasmatiques.
Chez l'homme, comme avec d'autres radiotraceurs cérébraux marqués au technétium (99mTc), qu'une valeur de débit sanguin supérieure aux valeurs physiologiques normales pouvait entraîner une sous-estimation du débit relatif avec le bicisate (99mTc).
Aucune étude de pharmacocinétique du bicisate (99mTc) n'a été réalisée sur des patients présentant des troubles neurologiques. Toutefois, la distribution intracérébrale d'une dose unique de 99mTc-bicisate a été évaluée chez des patients avec le temps, à l'aide de tomoscintigraphies TEMP répétées réalisées par deux investigateurs, le Docteur Vidabaek et le Docteur Moretti. Les images de bicisate (99mTc) obtenues ont démontré la même distribution intracérébrale globale que dans la première étude de scintigraphie. Ceci semble indiquer que, comme chez les sujets neurologiques normaux, la distribution du bicisate (99mTc) reste stable avec le temps.
Indications - BICISATE - usage systémique
Ce médicament est à usage diagnostique uniquement.
La scintigraphie au bicisate (99mTc) est indiquée dans l'évaluation des anomalies de la perfusion régionale cérébrale chez les patients adultes atteints d'affections du système nerveux central.
Effets indésirables - BICISATE - usage systémique
Les effets indésirables rapportés suite à l'utilisation de BICISATE dans des études (1022 patients) étaient généralement d'une intensité légère à modérée et transitoires.
Au cours du programme d'essais cliniques, 5,9% des patients ont présenté un effet indésirable. Les effets indésirables les plus fréquemment rapportés sont des maux de tête (1,0%) et une agitation (0,5%).
La fréquence des effets indésirables listés ci-dessous est définie par la convention suivante:
Très fréquent (≥1/10); fréquent (≥1/100, <1/10); peu fréquent (≥1/1000, <1/100); rare (≥1/10000, <1/1000); très rare (<1/10000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système nerveux: | Fréquent: maux de tête Peu fréquent: agitation, convulsions, parosmie (se manifestant par une légère odeur aromatique et transitoire), somnolence, hallucinations, anxiété, sensations vertigineuse |
Affections cardiaques: | Peu fréquent: angor, insuffisance cardiaque |
Affections vasculaires: | Peu fréquent: syncopes, hypertension |
Affections respiratoires, thoraciques et médiastinales: | Peu fréquent: apnée, cyanose |
Affections gastro-intestinales: | Peu fréquent: constipation, nausées, dyspepsie, diarrhée |
Affections de la peau et du tissu sous-cutané: | Peu fréquent: éruption transitoire |
Troubles musculo-squelettiques et systémiques: | Peu fréquent: douleurs dorsale |
Troubles généraux et anomalies au site d'administration: | Peu fréquent: malaise |
Affections du système immunitaire :
| Rare : réactions d'hypersensibilité (exprimées sous forme de prurit, érythème, urticaire, nausées, gonflement du visage ou des lèvres, hyperémie oculaire, hypotension). Rare : réactions anaphylactiques de légères à graves (sous forme d'dème, de gonflement des lèvres, d'hypotension) |
L'exposition aux radiations ionisantes peut induire l'apparition d'un cancer et potentialiser le développement de malformations congénitales. Étant donné que la plupart des examens à visée diagnostique pratiqués en médecine nucléaire se font avec des doses à faible radiation inférieure à 20 mSv le taux de probabilité de ces effets indésirables semble faible. La dose efficace pour un adulte (70 kg) est de 13,6 mSv quand l'activité maximale recommandée de 1700 MBq est administrée.
Dans le cas d'un surdosage de l'administration de radiation par BICISATE , la dose absorbée par le patient doit être réduite si possible en augmentant l'élimination du radionucléide du corps au moyen de mictions et de défécations fréquentes. Il peut s'avérer utile d'estimer la dose effectivement délivrée.
Aucune étude de reproduction animale n'a été réalisée avec le bicisate (99mTc). De même qu'aucune étude n'a été effectuée chez la femme enceinte.
Quand il est nécessaire d'administrer des produits radioactifs à la femme susceptible de procréer, des informations doivent être obtenues quant à une grossesse. Toute femme ayant un retard de règles doit être présumée enceinte jusqu'à preuve du contraire. Quand il existe un doute, il est important que l'exposition aux radiations soit minimale compte tenu de l'information clinique souhaitée. On envisagera d'autres examens ne mettant pas en jeu de radiations ionisantes.
L'utilisation de radionucléides chez la femme enceinte implique également des doses de radiation pour le ftus. Seuls les examens indispensables seront effectués pendant la grossesse, quand le bénéfice attendu est supérieur aux risques encourus par la mère et le ftus.
Avant administration de produit radioactif à la femme allaitante, il faut envisager la possibilité de reporter jusqu'au sevrage et si le meilleur choix du produit radiopharmaceutique a été fait, compte tenu de sa sécrétion dans le lait maternel. Si l'administration est jugée nécessaire, l'allaitement doit être suspendu pendant les 12 heures qui suivent l'administration et le lait produit pendant cette période doit être éliminé. L'allaitement pourra être repris lorsque l'activité présente dans le lait ne risque pas d'entraîner une dose d'irradiation de l'enfant supérieure à 1mSv.

 Français
Français Русский
Русский