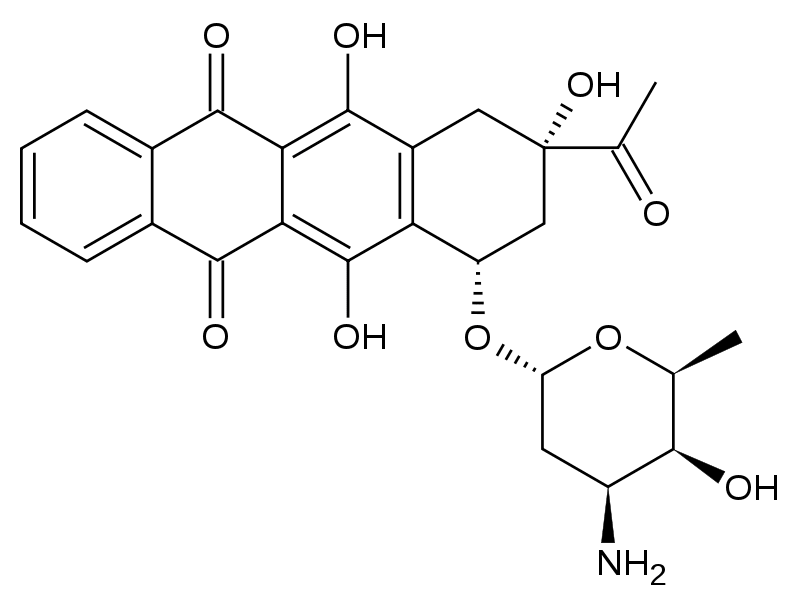
Pharmacodynamique
Antibiotique cytotoxique de la famille des anthracyclines.
L'idarubicine interagit avec l'ADN en s'intercalant entre 2 bases adjacentes, interagit avec la topoisomérase II, et a un effet inhibiteur sur la synthèse des acides nucléiques.
La modification apportée sur la position 4 du noyau de l'anthracycline confère à l'idarubicine une forte lipophilie ; de ce fait, l'idarubicine présente une meilleure pénétration intracellulaire que la doxorubicine ou la daunorubicine.
Le principal métabolite, l'idarubicinol, a montré une activité antitumorale in vivo et in vitro, sur des modèles expérimentaux.
Pharmacocinétique
Pharmacocinétique - IDARUBICINE - usage parentéral
Chez l'adulte, après une administration par voie orale de 10 à 60 mg/m² d'idarubicine, celle-ci était rapidement absorbée, avec l'obtention de concentrations plasmatiques maximales de 4 à 12,65 ng/ml 1 à 4 heures après l'administration. La demi-vie terminale était de 12,7±6,0 heures (moyenne ± ET). Après une administration intraveineuse d'idarubicine chez l'adulte, la demi-vie terminale était de 13,9±5,9 heures, semblable à celle observée après l'administration orale.
Après administration intraveineuse, l'idarubicine est largement métabolisée en métabolite actif, l'idarubicinol, qui est éliminé plus lentement, avec T1/2 plasmatique comprise entre 41 et 69 heures. Le médicament est éliminé par excrétion biliaire et rénale, principalement sous la forme d'idarubicinol.
Les études de concentration cellulaire du médicament (cellules nucléées sanguines et médullaires) chez des patients leucémiques ont montré que les concentrations maximales d'idarubicine sont atteintes quelques minutes après l'injection.
Les concentrations d'idarubicinol et d'idarubicine dans les cellules nucléées sanguines et médullaires sont plus de 100 fois celles du plasma. La vitesse de disparition de l'idarubicine du plasma et des cellules était pratiquement comparable à la demi-vie terminale d'environ 15 heures. La demi-vie terminale de l'idarubicinol dans les cellules était d'environ 72 heures.
Population pédiatrique :
Les mesures des paramètres pharmacocinétiques chez 7 patients pédiatriques recevant de l'idarubicine par voie intraveineuse à des doses allant de 15 à 40 mg/m²/3 jours de traitement ont mis en évidence une demi-vie médiane de l'idarubicine de 8,5 heures (intervalle : 3,6 26,4 h). Le métabolite active idarubicinol s'est accumulé pendant les 3 jours de traitement, et affichait une demi-vie médiane de 43,7 heures (intervalle : 27,8 131 h).
Dans une autre étude, les mesures des paramètres pharmacocinétiques chez 15 patients pédiatriques recevant de l'idarubicine par voie orale à des doses allant de 30 à 50 mg/m² pendant les 3 jours de traitement, la concentration plasmatique maximale d'idarubicine était de 10,6 ng/mL (intervalle : 2,7 16,7 ng/mL à la dose de 40 mg/m²). La demi-vie terminale médiane de l'idarubicine était de 9,2 heures (intervalle : 6,4 25,5 h). Une accumulation importante d'idarubicinol a été observée au cours de la période de traitement de 3 jours. La valeur de la demi-vie terminale de l'idarubicine observée après administration intraveineuse était comparable à celle observée après une administration orale chez les patients pédiatriques.
Étant donné que la Cmax de l'idarubicine est similaire chez les enfants et les adultes après des administrations orales, la cinétique d'absorption ne semble pas différer entre les adultes et les enfants.
Les valeurs des demi-vies d'élimination de l'idarubicine chez les enfants et les adultes diffèrent après des administrations orales et intraveineuses :
Les valeurs de 30 à 107,9 L/h/m² rapportées pour la clairance corporelle totale de l'idarubicine chez les adultes sont supérieures aux valeurs de 18 à 33 l/h/m² rapportées chez les populations pédiatriques. Bien que l'idarubicine ait un très large volume de distribution aussi bien chez l'adulte que chez l'enfant, suggérant une liaison tissulaire importante du médicament, la demi-vie d'élimination plus courte et la clairance corporelle totale inférieure ne sont pas entièrement expliquées par un volume de distribution apparent plus faible chez l'enfant que chez l'adulte
Dosage
Dosage - IDARUBICINE - voie orale
Gélule
Deux schémas posologiques sont proposés :
Schéma hebdomadaire :
Traitements d'induction et de consolidation: la dose recommandée est de 20 mg/m2 par semaine, pendant 4 semaines.
Traitement de rattrapage : chez les patients non répondeurs, la dose pourra être augmentée à 40 mg/m2 par semaine, pendant 4 semaines.
Schéma quotidien :
La dose recommandée est de 30 mg/m2 par jour, pendant 3 jours consécutifs, en monochimiothérapie ou entre 15 et 30 mg/m2 par jour pendant 3 jours consécutifs, en association avec d'autres cytostatiques.
Ces schémas posologiques doivent être considérés en tenant compte de l'état hématologique du patient et des doses des autres cytotoxiques associés.
Chez les patients présentant une insuffisance hépatique, la dose doit être réduite .
Mode et voie d'administration
Afin d'éviter tout contact avec la peau, la prise des gélules s'effectue directement à partir du flacon. Elles doivent être avalées entières avec un peu d'eau ; en aucun cas, elles ne doivent être ouvertes, sucées, mâchées, ni même mordues.
Les gélules peuvent être prises au cours d'un repas léger.
Dosage - IDARUBICINE - usage parentéral
Solution pour perfusion
La dose est généralement calculée en fonction de la surface corporelle (mg/m²). Voie intraveineuse.
Leucémie aiguë non lymphoblastique (LAM)
Adultes : dans la leucémie aiguë non lymphoblastique, la dose recommandée est de 12 mg/m² par IV par jour pendant 3 jours en association avec la cytarabine. Une autre posologie qui pourrait être utilisée dans la leucémie aiguë non lymphoblastique, en monothérapie ou en association, est de 8 mg/m² par IV par jour pendant 5 jours.
Enfants : la fourchette posologique recommandée est de 10-12 mg/m² par IV par jour pendant 3 jours en association à la cytarabine.
Leucémie aiguë lymphoblastique (LAL)
Adultes : en monothérapie, la dose suggérée est de 12 mg/m² par IV par jour pendant 3 jours.
Enfants : en monothérapie, la dose suggérée est de 10 mg/m² par IV. par jour pendant 3 jours.
Remarque : Ces posologies sont données uniquement à titre indicatif. Veuillez-vous reporter aux protocoles particuliers pour les posologies exactes.
Tous les schémas posologiques doivent prendre en compte l'état hématologique du patient, et les posologies des autres médicaments cytotoxiques lorsqu'ils sont utilisés en association.
Mode d'administration
L'administration intraveineuse de l'idarubicine doit être effectuée avec précautions. Il est recommandé d'administrer l'idarubicine sur une période de 5 à 10 minutes, dans la tubulure d'une perfusion intraveineuse de chlorure de sodium à 0,9 %. Cette technique permet de minimiser le risque de thrombose ou d'extravasation périveineuse qui peut conduire à une cellulite grave, une vésication et une nécrose tissulaire. L'injection directe n'est pas recommandée en raison du risque d'extravasation, qui peut se produire même avec un retour sanguin adéquat par aspiration à travers l'aiguille.
Poudre pour solution pour perfusion
Leucémies aiguës myéloblastiques (LAM) :
Chez l'adulte, la dose recommandée est de 12 mg/m2 par jour en IV pendant 3 jours consécutifs, ou 8 mg/m2 par jour en IV pendant 5 jours consécutifs.
Régimes en association :
Chez les enfants atteints de LAM l'intervalle de dose recommandé pour le chlorhydrate d'idarubicine en association avec la cytarabine est de 10 à 12 mg/m2 de surface corporelle et par jour pendant 3 jours en injection intraveineuse lente.
REMARQUE : ces recommandations sont générales. Pour la posologie exacte, reportez-vous aux protocoles individuels.
Leucémies aiguës lymphoblastiques (LAL) :
Chez l'adulte, la dose recommandée est de 12 mg/m2 par jour en IV pendant 3 jours consécutifs ; chez l'enfant, la dose recommandée est de 10 mg/m2 par jour en IV pendant 3 jours consécutifs.
Dose cumulative :
Une dose cumulative de 93 mg/m2 apparaît rarement cardiotoxique chez l'adulte. Le petit enfant peut être plus susceptible à la cardioxicité cumulative.
Ces schémas posologiques doivent être considérés en tenant compte de l'état hématologique du patient et des doses des autres cytotoxiques associés.
Mode d'administration
Reconstitution du produit : dissoudre le contenu du flacon de 10 mg dans 10 ml d'eau pour préparations injectables.
Administration : voie intraveineuse stricte; la solution reconstituée doit être injectée dans la tubulure d'une perfusion intraveineuse de chlorure de sodium à 0,9 % ou de dextrose à 5 %, en 5 à 10 minutes.
Une injection directe n'est pas recommandée en raison du risque d'extravasation, qui peut également se produire même en présence d'un retour veineux .
En cas d'extravasation, l'administration sera interrompue immédiatement.
Attention :
Il est extrêmement important de s'assurer que l'administration est intraveineuse. Toute extravasation risquerait de produire une nécrose de tissus environnants.
Dans ce cas, il convient d'interrompre immédiatement l'injection.
Modalités de manipulation
La préparation des solutions injectables de cytotoxiques doit être obligatoirement réalisée par un personnel spécialisé et entraîné ayant une connaissance des médicaments utilisés, dans des conditions assurant la protection de l'environnement et surtout la protection du personnel qui manipule. Elle nécessite un local de préparation réservé à cet usage. Il est interdit de fumer, de manger, de boire dans ce local. Les manipulateurs doivent disposer d'un ensemble de matériel approprié à la manipulation notamment de blouses à manches longues, masques de protection, calot, lunettes de protection, gants à usage unique stériles, champs de protection du plan de travail, conteneurs et sacs de collecte des déchets. Les excréta et les vomissures doivent être manipulés avec précaution. Les femmes enceintes doivent être averties et éviter la manipulation de cytotoxiques. Tout contenant cassé doit être traité avec les mêmes précautions et considéré comme un déchet contaminé. L'élimination des déchets contaminés se fait par incinération dans des conteneurs rigides étiquetés à cet effet.
Ces dispositions peuvent être envisagées dans le cadre du réseau de cancérologie (circulaire DGS/DH/98 N° 98/188 du 24 mars 1998) en collaboration avec toute structure adaptée et remplissant les conditions requises.
Indications
Indications - IDARUBICINE - usage systémique
Leucémies aiguës myéloblastiques.
Le chlorhydrate d'idarubicine, en association avec la cytarabine est indiqué dans le traitement de 1ère ligne d'induction de la rémission chez des enfants non précédemment traités et atteints de leucémie aiguë myéloïde (LAM).
Leucémies aiguës lymphoblastiques en rechute.
Contre-indications
sa prescription doit être évitée chez les sujets présentant une cardiopathie avec insuffisance myocardique,
insuffisance rénale grave,
insuffisance hépatique grave,
infections non contrôlées,
allaitement ,
vaccins vivants atténués (contre fièvre jaune, varicelle, zona, rougeole, oreillons, rubéole, tuberculose, rotavirus, grippe) et ce pendant les 6 mois suivant l'arrêt de la chimiothérapie ,
insuffisance cardiaque sévère,
infarctus du myocarde récent de moins de 6 mois,
cardiomyopathie sévère,
arythmie sévère,
myélosupression persistante,
traitements antérieurs par chlorhydrate d'idarubicine et/ou d'autres anthracyclines ou anthracènediones aux doses maximales cumulatives .
Effets indésirables
Effets indésirables - IDARUBICINE - usage systémique
Les effets indésirables suivants ont été observés et rapportés au cours du traitement par IDARUBICINE avec les fréquences suivantes : très fréquent (³1/10), fréquent (³1/100, <1/10), peu fréquent (³1/1000, <1/100), rare (³1/10 000, <1/1000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Infections et infestations :
Très fréquent : Infection.
Peu fréquent : Sepsis/septicémies.
Tumeurs bénignes, malignes et non précisées :
Peu fréquent : Leucémies secondaires (leucémies myéloïdes aiguës, et syndrome myélodysplasique).
Affections hématologiques et du système lymphatique :
Très fréquent : Anémies, leucopénies, neutropénies, neutropénie fébrile, pancytopénies, thrombocytopénies.
Affections du système immunitaire :
Très rare : Anaphylaxie.
Troubles du métabolisme et de la nutrition :
Très fréquent : Anorexie.
Peu fréquent : Hyperuricémie (syndrome de lyse tumorale), déshydratation.
Fréquence indéterminée : Hyperphosphorémie, hyperkaliémie, hypocalcémie, hyperphosphaturie (syndrome de lyse tumorale).
Affections cardiaques :
Très fréquent : Tachycardie sinusale, tachyarythmies, bradycardie, diminution asymptomatique de la fraction d'éjection ventriculaire gauche.
Fréquent : Cardiomyopathie.
Peu fréquent : Anomalies de l'ECG (dont modifications non spécifiques du segment ST), infarctus du myocarde, insuffisance cardiaque congestive.
Très rare : Bloc auriculo-ventriculaire, bloc de branche, myocardite, péricardite.
Affections vasculaires :
Fréquent : Phlébite, thrombose veineuse profonde, hémorragies.
Peu fréquent : Choc.
Très rare : Bouffées de chaleur, embolie pulmonaire.
Affections gastro-intestinales :
Très fréquent : Nausées, vomissements et diarrhées, mucite/stomatite, douleurs abdominales ou sensations de brûlures.
Fréquent : Hémorragies du tractus gastro-intestinal, coliques.
Peu fréquent : sophagites et colites (incluant des entérocolites sévères/ entérocolites neutropéniques avec perforation).
Très rare : Erosions/ulcérations.
Affections de la peau et du tissu sous-cutané :
Toxicité locale (fréquence indéterminée) :
En cas d'extravasation : douleur locale, lésions tissulaires sévères (formation de vésicules, inflammation sévère du tissu sous-cutané).
En cas de réaction au point d'injection : scléroses au sein des petits vaisseaux.
Très fréquent : Alopécie.
Fréquent : Rash, prurit, réactions cutanées réactivées dans la zone irradiée.
Peu fréquent : Urticaire, hyperpigmentation cutanée et unguéale, cellulite pouvant être sévère, nécrose tissulaire.
Très rare : Erythème acral.
Affections du rein et des voies urinaires :
Très fréquent : Coloration en rouge des urines 1 à 2 jours après administration.
Troubles généraux et anomalies au site d'administration :
Très fréquent : Fièvre, céphalée, frisson
Investigations:
Très fréquent : Diminutions asymptomatiques de la fraction d'éjection ventriculaire gauche, anomalies de l'ECG (anomalie de l'onde T).
Fréquent : Elévations des enzymes hépatiques et de la bilirubine.
Affection du système nerveux
Rare : hémorragie cérébrale.
Système hématopoïétique
Une myélosuppression marquée est l'effet indésirable le plus sévère du traitement par IDARUBICINE. Celle-ci est toutefois nécessaire à l'éradication des cellules leucémiques .
Cardiotoxicité
Une insuffisance cardiaque congestive menaçant le pronostic vital est la forme la plus sévère de cardiomyopathie induite par les anthracyclines et représente la toxicité cumulative dose-limitante .
Description de certains effets indésirables
Gastro-intestinaux
Stomatite et, dans certains cas graves, ulcération de la muqueuse, déshydratation due à des vomissements et diarrhées sévères ; risque de perforation du colôn.
Autres effets indésirables : hyperuricémie
Une prévention des symptômes de l'hyperuricémie, par hydratation, alcalinisation des urines et prophylaxie par allopurinol, peut minimiser les complications potentielles du syndrome de lyse tumorale.
Les effets indésirables sont similaires chez les adultes et les enfants, à l'exception d'une plus grande susceptibilité à la toxicité cardiaque induite par les anthracyclines chez les enfants.
Surdosage
Le surdosage comporte un risque de toxicité myocardique aiguë et différée et un risque de majoration de la myélodépression et des autres effets indésirables.
L'administration de très fortes doses d'idarubicine risque de provoquer une toxicité myocardique aiguë dans les 24 heures et une myélodépression sévère pendant les 7 à 14 jours suivants.
Le traitement repose sur le maintien des fonctions vitales dans des unités de soins spéciales, sur des mesures comme des transfusions sanguines et des soins infirmiers palliatifs.
Des cas d'insuffisance cardiaque différée ont été observés plusieurs mois après le surdosage en anthracyclines.
Il convient donc de surveiller soigneusement le patient et, si des signes d'insuffisance cardiaque apparaissent, d'instaurer un traitement adéquat.
Grossesse/Allaitement
Grossesse
Il n'y a pas de données pertinentes concernant l'utilisation de l'idarubicine chez la femme enceinte.
Les études chez l'animal ont montré que l'idarubicine est embryotoxique et tératogène chez le rat mais pas chez le lapin .
Les femmes traitées ne doivent pas être enceintes durant le traitement par l'idarubicine et doivent utiliser une méthode efficace de contraception.
Si l'idarubicine est utilisée pendant la grossesse, ou si une patiente découvre sa grossesse durant le traitement, la patiente doit être informée du risque potentiel pour le ftus.
Les hommes traités par l'idarubicine ne doivent pas concevoir pendant toute la durée du traitement et jusqu'à 3 mois après la fin du traitement et doivent conserver leur sperme avant de débuter le traitement.
Allaitement
Le passage de l'idarubicine dans le lait maternel n'est pas connu. Le risque pour l'enfant allaité ne peut être exclu. L'allaitement doit être arrêté durant le traitement par l'idarubicine.
Fertilité
L'idarubicine peut induire une atteinte chromosomique des spermatozoïdes et/ou une infertilité. Pour ces raisons, les hommes traités par l'idarubicine ne doivent pas concevoir pendant toute la durée du traitement et jusqu'à 3 mois après la fin du traitement et doivent conserver leur sperme avant de débuter le traitement .
Interactions avec d'autres médicaments
IDARUBICINE, en association avec d'autres chimiothérapies, peut conduire à une toxicité additive et notamment concernant les effets médullaires/hématologiques et les effets gastro-intestinaux . L'utilisation de IDARUBICINE dans des chimiothérapies associant d'autres produits potentiellement cardiotoxiques, de même que l'utilisation concomitante d'autres produits à visée cardiaque (par ex., anticalciques) requièrent une surveillance de la fonction cardiaque tout au long du traitement.
Les modifications de la fonction hépatique ou rénale induites par des traitements concomitants peuvent affecter le métabolisme, la pharmacocinétique, l'efficacité et/ou la toxicité de l'idarubicine .
Une myélosuppression additive peut apparaître quand une radiothérapie est réalisée de manière concomitante, ou 2 à 3 semaines avant le traitement par IDARUBICINE.
INTERACTIONS COMMUNES A TOUS LES CYTOTOXIQUES
Associations contre-indiquées
Vaccins vivants atténués (contre fièvre jaune, varicelle, zona, rougeole, oreillons, rubéole, tuberculose, rotavirus, grippe) et ce pendant les 6 mois suivant l'arrêt de la chimiothérapie.
Risque de maladie vaccinale généralisée éventuellement mortelle.
Associations déconseillées
+ Phénytoïne (et, par extrapolation, fosphénytoïne)
Risque de survenue de convulsions par diminution de l'absorption digestive de la seule phénytoïne par le cytotoxique, ou bien risque de majoration de la toxicité ou de perte d'efficacité du cytotoxique par augmentation de son métabolisme hépatique par la phénytoïne ou la fosphénytoïne.
Associations faisant l'objet de précautions d'emploi
+ Antivitamines K
Augmentation du risque thrombotique et hémorragique au cours des affections tumorales. De surcroît, possible interaction entre les AVK et la chimiothérapie.
Contrôle plus fréquent de l'INR.
Associations à prendre en compte
+ Immunosuppresseurs (ciclosporine, évérolimus, sirolimus, tacrolimus, temsirolimus)
Immunodépression excessive avec risque de syndrome lymphoprolifératif.

 Français
Français Русский
Русский