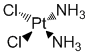Pharmacodynamique
Son mécanisme d'action est similaire à celui des alkylants. Le cisplatine se lie avec l'ADN dont il inhibe la synthèse des ponts inter et intracaténaires. L'inhibition des synthèses de l'ARN et des protéines cellulaires n'intervient que secondairement.
Pharmacocinétique
Pharmacocinétique - CISPLATINE - voie orale
Les études de pharmacocinétiques pratiquées chez l'homme ont montré que le cisplatine se distribue dans la plupart des tissus, en notant les plus fortes concentrations dans le foie et le rein avec une absence presque totale du produit dans le tissu cérébral.
Le cisplatine se lie aux protéines plasmatiques dans la proportion de 90 à 95%; cette fraction ne possède aucune activité cytotoxique pour des cellules en culture. De plus, cette fixation est quasi irréversible
Le profil pharmacocinétique fait apparaître:
une décroissance biphasique pour le platine libre et le platine lié aux protéines de faible poids moléculaires avec une T½α de 26 à 30 minutes une T½β de 50 à 60 minutes;
une décroissance plasmatique du platine lié aux protéines qui se fait selon un T½ α de 30 à 50 minutes; T½β de 72 à 192 heures.
Il est en général admis qu'au bout de 5 à 6 demi-vies, soit 4 à 6 heures après l'injection, il ne reste pratiquement plus de platine libre circulant, supposé actif.
L'élimination est essentiellement urinaire, soit dans les premières heures pour le platine libre, soit beaucoup plus lentement pour le platine lié, qui doit être métabolisé.
Les études in vitro avec le plasma humain ont montré que la liaison aux protéines est pratiquement irréversible; il est hautement improbable que le complexe cisplatine-protéines puisse être la source d'un relargage de cisplatine dans le sang circulant.
Pharmacocinétique - CISPLATINE - usage parentéral
Les études de pharmacocinétiques pratiquées chez l'homme ont montré que le cisplatine se distribue dans la plupart des tissus, en notant les plus fortes concentrations dans le foie et le rein avec une absence presque totale du produit dans le tissu cérébral.
Le cisplatine se lie aux protéines plasmatiques dans la proportion de 90 à 95%; cette fraction ne possède aucune activité cytotoxique pour des cellules en culture. De plus, cette fixation est quasi irréversible
Le profil pharmacocinétique fait apparaître:
une décroissance biphasique pour le platine libre et le platine lié aux protéines de faible poids moléculaires avec une T½α de 26 à 30 minutes une T½β de 50 à 60 minutes;
une décroissance plasmatique du platine lié aux protéines qui se fait selon un T½ α de 30 à 50 minutes; T½β de 72 à 192 heures.
Il est en général admis qu'au bout de 5 à 6 demi-vies, soit 4 à 6 heures après l'injection, il ne reste pratiquement plus de platine libre circulant, supposé actif.
L'élimination est essentiellement urinaire, soit dans les premières heures pour le platine libre, soit beaucoup plus lentement pour le platine lié, qui doit être métabolisé.
Les études in vitro avec le plasma humain ont montré que la liaison aux protéines est pratiquement irréversible; il est hautement improbable que le complexe cisplatine-protéines puisse être la source d'un relargage de cisplatine dans le sang circulant.
Dosage
Dosage - CISPLATINE - usage parentéral
Solution injectable pour perfusion
La solution obtenue après dilution du CISPLATINE avec le solvant doit être administrée par voie intraveineuse stricte dans la tubulure de perfusion.
En monothérapie:
La posologie unitaire chez l'adulte et chez l'enfant est de 50 à 100 mg/m2 de surface corporelle en administration intraveineuse stricte de 30 minutes à 2 heures toutes les 3 à 6 semaines, le plus souvent:
soit en perfusion unique,
soit en administration fractionnée sur 5 jours.
Une hydratation préalable sera réalisée par perfusion d'au minimum 1 à 2 litres de solution contenant au minimum 80 mmol/l de chlorure de sodium administrés en 6 à 12 heures.
Une hydratation et une diurèse adéquate doivent être maintenues 24 heures après l'administration du produit.
En association:
Les doses de cisplatine seront modifiées en fonction de la nature et de la toxicité propre de chaque composant de l'association, séparément et associé.
L'aluminium réagit avec cisplatine en formant un précipité noir et des gaz. Le matériel pour la préparation ou l'administration de cisplatine ne doit pas comporter d'aluminium (aiguille, seringue, cathéter,
)
Modalités d'administration:
L'administration de ciplastine doit se faire par voie intraveineuse stricte. En cas d'extravasation, des mesures correctrices doivent être appliquées dont en premier lieu l'arrêt de la perfusion. |
Modalités de manipulation:
La préparation des solutions injectables de cytotoxiques doit être obligatoirement réalisée par un professionnel spécialisé et entraîné ayant une connaissance des médicaments utilisés, dans des conditions assurant la protection de l'environnement et surtout la protection du personnel qui le manipule. Elle nécessite un local de préparation réservé à cet usage. Il est interdit de fumer, de manger, de boire dans ce local. Les manipulateurs doivent disposer d'un ensemble de matériel approprié à la manipulation notamment blouses à manches longues, masques de protection, calot, lunettes de protection, gants à usage unique stériles, champs de protection du plan de travail, conteneurs et sacs de collecte des déchets. Les excréta et les vomissures doivent être manipulés avec précaution. Les femmes enceintes doivent être averties et éviter la manipulation des cytotoxiques. Tout contenant cassé doit être traité avec les mêmes précautions et considéré comme un déchet contaminé. L'élimination des déchets contaminés se fait par incinération dans des conteneurs rigides étiquetés à cet effet. |
Ces conditions peuvent être envisagées dans le cadre du réseau de cancérologie (circulaire DGS/DH/98 N°98/188 du 24 mars 1998) en collaboration avec toute structure adaptée et remplissant les conditions requises.
Solution à diluer pour perfusion
Méthode d'administration :
CISPLATINE 1 mg/ml solution à diluer pour perfusion doit être dilué avant l'administration.
La solution diluée doit être administrée uniquement par perfusion intraveineuse (voir ci-dessous).
Lors de l'administration, éviter tout dispositif contenant de l'aluminium qui peut entrer en contact avec le cisplatine (kits pour perfusion intraveineuse, aiguilles, cathéters, et seringues) .
Posologie
Adultes et enfants :
La posologie de cisplatine dépend du cancer primitif, de la réaction attendue, et de l'administration en monothérapie ou comme composant d'une polychimiothérapie.
Les recommandations posologiques sont applicables chez les adultes et les enfants.
En monothérapie, les deux schémas posologiques suivants sont recommandés :
une dose unique de 50 à 120 mg/m² de surface corporelle toutes les 3 à 4 semaines,
15 à 20 mg/m²/jour, sur 5 jours consécutifs tous les 3 à 4 semaines.
Si le cisplatine est utilisé dans une chimiothérapie en association, la dose doit être réduite. La dose habituelle est de 20 mg/m² ou plus, en dose unique toutes les 3 à 4 semaines.
Pour le traitement du cancer du col de l'utérus, le cisplatine est utilisé en association avec une radiothérapie. La dose habituelle est de 40 mg/m2 par semaine pendant 6 semaines.
Chez les patients atteints d'altération de la fonction rénale ou de dépression médullaire, la dose doit être réduite de manière adéquate.
La solution de cisplatine pour perfusion préparée selon les instructions doit être administrée par perfusion intraveineuse pendant 6 à 8 heures.
Une hydratation adéquate doit être maintenue de 2 à 12 heures avant l'administration jusqu'à 6 heures minimum après l'administration du cisplatine. L'hydratation est nécessaire pour assurer une diurèse suffisante pendant et après le traitement par cisplatine. Elle est réalisée par la perfusion intraveineuse d'une des solutions ci-après :
solution de chlorure de sodium à 0,9%,
mélange d'une solution de chlorure de sodium à 0,9% et d'une solution de glucose 5% (1:1).
Hydratation avant le traitement par cisplatine :
perfusion intraveineuse de 100 à 200ml/heure sur une durée de 6 à 12 heures, pour une quantité totale d'au moins 1L.
Hydratation après la fin de l'administration de cisplatine :
Perfusion intraveineuse de 2 autres litres à un débit de 100 à 200 ml par heure sur une durée de 6 à 12 heures.
Une diurèse forcée peut être requise si la sécrétion de l'urine s'avère inférieure à 100 à 200 ml/heure après hydratation. Il est possible de réaliser la diurèse forcée en administrant par voie intraveineuse 37,5 g de mannitol comme solution à 10% (375 ml de mannitol en solution de 10%), ou un diurétique, si la fonction rénale est normale.
L'administration de mannitol ou d'un diurétique est également requise si la dose de cisplatine administrée est supérieure à 60 mg/m2 de surface corporelle.
Le patient doit impérativement boire de grandes quantités de liquides pendant les 24 heures suivant la perfusion de cisplatine pour assurer la sécrétion d'urine adéquate.
Préparation de la solution par voie intraveineuse - Mise en garde
Comme pour tous les autres produits potentiellement toxiques, des précautions sont indispensables lors de la manipulation de la solution de cisplatine. Des lésions cutanées sont possibles en cas d'exposition accidentelle au produit. Il est conseillé de porter des gants. Si la solution de cisplatine entre en contact avec la peau ou les muqueuses, laver la peau ou les muqueuses vigoureusement avec du savon et de l'eau.
Se conformer scrupuleusement aux procédures appropriées pour la manipulation et l'élimination des agents cytostatiques.
Avant d'administrer la solution au patient, vérifier la clarté de la solution et l'absence de particules.
Indications
Indications - CISPLATINE - usage systémique
Les indications thérapeutiques sont limitées à:
tumeurs du testicule,
tumeurs de l'ovaire,
tumeurs du col de l'utérus,
tumeurs de l'endomètre,
tumeurs de la sphère O.R.L.,
tumeurs de l'sophage,
tumeurs de la vessie,
cancers épidermoïdes,
cancers bronchiques,
cancers de l'estomac.
Le cisplatine est habituellement utilisé en polychimiothérapie en association avec d'autres médicaments antinéoplasiques.
Contre-indications
allergie reconnue au cisplatine ou aux produits contenant du platine.
femme enceinte ou qui allaite: .
Vaccin contre la fièvre jaune et phénytoïne à visée prophylactique .
Effets indésirables
Effets indésirables - CISPLATINE - usage systémique
La toxicité rénale est liée à la dose. Elle est cumulative et peut conduire à limiter les doses de cisplatine. Une insuffisance rénale, se traduisant par une augmentation de l'urée ou de la créatininémie et (ou) une réduction de la clairance de la créatinine, a été observée chez certains sujets traités par une dose unique de 50 mg/m2. Des troubles hydro-électrolytiques en particulier hypomagnésémie et hypocalcémie, peuvent survenir probablement en rapport avec l'atteinte tubulaire.
Observée habituellement pour des doses supérieures à 50 mg/m2 une hyperuricémie survient aussi fréquemment que l'atteinte rénale.
Chez certains sujets traités par une seule dose de 50 mg/m2 de cisplatine, il a été observé une ototoxicité se traduisant par des bourdonnements d'oreille et une perte auditive au niveau des hautes fréquences (4 000 et 8000 Hz). Plus rarement, la perte auditive portait sur les fréquences conversationnelles. Uni ou bilatérale, l'ototoxicité devient plus fréquente et plus sévère avec la répétition des doses.
Une myélodépression a été observée chez quelques sujets traités par le cisplatine, se traduisant par une leucopénie, une thrombopénie ou une anémie dont le maximum se situait généralement vers la 3ème semaine, la récupération s'effectuant le plus souvent vers la 5ème ou 6ème semaine.
Des nausées et vomissement surviennent chez presque tous les malades, une à quatre heures après l'administration du produit. Un traitement préventif, voire curatif, par un antiémétique puissant est conseillé pour s'assurer de la compliance du patient.
Des neuropathies périphériques ont été signalées, le plus souvent après des traitements prolongés (4 à 7 mois). Des pertes de goût et de la sensibilité ont également été rapportées.
Des réactions de type anaphylactique peuvent survenir dans les minutes qui suivent l'injection du produit: dème facial, dyspnée, tachycardie, hypotension. L'adrénaline, les corticoïdes ou les antihistaminiques en ont atténué les effets.
Plus rarement, ont été signalés des troubles cardiaques, une anorexie, une élévation des transaminases.
De rares atteintes neurologiques centrales ont été rapportées: encéphalopathie, convulsions, cécité corticale.
De très rares cas de thrombose artérielle ou veineuse, ainsi que des accidents vasculaires cérébraux ont été rapportés.
Surdosage
En cas de surdosage, on doit s'attendre à ce que les effets secondaires soient exagérés. Il faut donc surveiller de façon très stricte les fonctions rénales et auditives et effectuer quotidiennement des numérations et formules sanguines pour guider d'éventuels gestes symptomatiques.
En cas de surdosage, une hémodialyse pourra être réalisée pour éviter toute fixation excessive du produit au niveau du parenchyme rénal.
Grossesse/Allaitement
Grossesse
Fertilité: un traitement par le cisplatine peut provoquer une stérilité définitive. Les hommes qui souhaitent avoir des enfants par la suite doivent être informés avant traitement, des possibilités de cryoconservation du sperme.
Grossesse: Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (effet tératogène, mutagène, carcinogenèse transplacentaire) . En clinique, il n'existe pas actuellement de données suffisamment pertinentes pour évaluer un éventuel effet malformatif ou ftotoxique du cisplatine lorsqu'il est administré pendant la grossesse. Le cisplatine est contre-indiqué pendant la grossesse. Recommandation: Pendant le traitement par le cisplatine et pendant les 4 mois suivants, des mesures appropriées doivent être prises afin d'éviter toute conception; cela s'applique aux patients des deux sexes. Si un patient ou une patiente souhaite avoir un enfant après la fin du traitement par le cisplatine, il est conseillé de consulter un généticien.
Allaitement
Le cisplatine est excrété dans le lait maternel. L'allaitement est contre-indiqué pendant le traitement.
Interactions avec d'autres médicaments
Interactions communes à tous les cytotoxiques:
En raison de l'augmentation du risque thrombotique lors des affections tumorales, le recours à un traitement anticoagulant est fréquent. La grande variabilité intra-individuelle de la coagulabilité au cours de ces affections, à laquelle s'ajoute l'éventualité d'une interaction entre les anticoagulants oraux et la chimiothérapie anticancéreuse, imposent, s'il est décidé de traiter le patient par anticoagulants oraux, d'augmenter la fréquence des contrôles de l'INR.
Associations contre-indiquées
+ Phénytoïne (introduite en prophylaxie de l'effet convulsivant de certains anticancéreux).
Risque de survenue de convulsions par diminution de l'absorption digestive de la phénytoïne par le cytotoxique.
+ Vaccin contre la fièvre jaune:
Risque de maladie vaccinale généralisée mortelle.
Associations déconseillées
+ Vaccins vivants atténués (sauf fièvre jaune).
Risque de maladie vaccinale généralisée éventuellement mortelle.
Ce risque est majoré chez les sujets déjà immunodéprimés par la maladie sous-jacente.
Utiliser un vaccin inactivé lorsqu'il existe (poliomyélite).
Associations faisant l'objet de précautions d'emploi
+ Phénytoïne (en cas de traitement antérieur à la chimiothérapie).
Risque de survenue de convulsions par diminution de l'absorption digestive de la phénytoïne par le cytotoxique.
Associer momentanément une benzodiazépine anticonvulsivante.
Associations à prendre en compte
+ Ciclosporine (et par extrapolation, Tacrolimus).
Immunodépression excessive avec risque de lymphoprolifération.
Interactions spécifiques au cisplatine:
Associations à prendre en compte
+ Aminosides (voie parentérale)
Addition des effets néphrotoxiques, notamment en cas d'insuffisance rénale préalable et addition des effets ototoxiques.

 Français
Français Русский
Русский