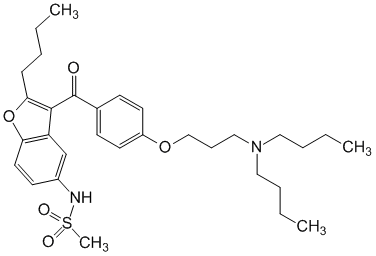
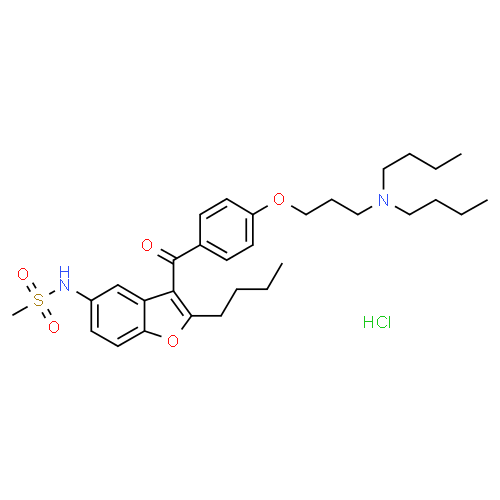
Chez les animaux, la
dronédarone prévient la fibrillation auriculaire ou rétablit le rythme sinusal normal selon le modèle utilisé. Elle prévient également la survenue de tachycardie et de fibrillation ventriculaire dans plusieurs modèles animaux. Ces effets découlent certainement de ses propriétés électrophysiologiques appartenant aux quatre classes de Vaughan-Williams. La dronédarone est un inhibiteur multicanal inhibant les courants potassiques (incluant IK [Ach], IKur, IKr, IKs) et prolongeant ainsi le potentiel d'action cardiaque et les périodes réfractaires (classe III). Elle inhibe aussi les courants sodiques (classe Ib) et les courants calciques (classe IV). C'est un antagoniste adrénergique non compétitif (classe II).
Propriétés pharmacodynamiques : Dans des modèles animaux, la dronédarone réduit la fréquence cardiaque. Elle prolonge la longueur du cycle de Wenckebach et les intervalles AH, PQ, QT ; sans effet marqué ou avec une augmentation faible de l'intervalle QTc, et sans changement sur les intervalles HV et QRS. Elle augmente les périodes réfractaires effectives (PRE) de l'oreillette et du nœud auriculoventriculaire. Les PRE ventriculaires sont légèrement prolongées avec un degré minimal de relation inverse à la fréquence. La dronédarone diminue la pression artérielle et la contractilité myocardique (dP/dt max) sans modification de la fraction d'éjection ventriculaire gauche et réduit la consommation d'oxygène myocardique. La dronédarone a des propriétés vasodilatatrices au niveau des artères coronaires (liées à l'activation de la voie oxyde nitrique ) et des artères périphériques. La dronédarone montre des effets antiadrénergiques indirects et un antagonisme partiel à la stimulation adrénergique. Sur la pression artérielle, elle réduit la réponse alpha-adrénergique à l'adrénaline et les réponses ß1 et ß2 à l'isoprénaline.
Pharmacocinétique - DRONÉDARONE - voie orale
Absorption : Après administration orale, en présence de nourriture, la dronédarone est bien absorbée (au moins 70 %). Cependant, en raison d'un premier passage métabolique présystémique, la biodisponibilité absolue de la dronédarone (prise avec l'alimentation) est de 15 %. Une prise de nourriture concomitante augmente la biodisponibilité de la dronédarone de 2 à 4 fois en moyenne. Après administration orale en présence de nourriture, les concentrations plasmatiques maximales de la dronédarone et de son principal métabolite actif circulant (métabolite N-débutylé) sont atteintes en 3 à 6 heures. Après administration répétée de 400 mg deux fois par jour, l'état d'équilibre est atteint en 4 à 8 jours de traitement et le facteur d'accumulation de la dronédarone varie de 2,6 à 4,5. La concentration maximale (Cmax) moyenne à l'état d'équilibre de la dronédarone se situe entre 84 et 147 ng/ml et l'exposition au métabolite principal N-débutylé est semblable à celle du produit parent. Les paramètres pharmacocinétiques de la dronédarone et de son métabolite N-débutylé s'écartent modérément de la dose-proportionnalité : une augmentation de deux fois la dose correspond approximativement à une augmentation de 2,5 et 3 fois pour la Cmax et l'AUC, respectivement.
Distribution : La liaison in vitro aux protéines plasmatiques de la dronédarone et de son métabolite N-débutylé est respectivement de 99,7 % et 98,5 % et n'est pas saturable. Les deux produits se lient principalement à l'albumine. Après administration intraveineuse (IV) le volume de distribution à l'état d'équilibre (Vss) est compris entre 1200 et 1400 l.
Biotransformation : La dronédarone est fortement métabolisée, principalement par le CYP3A4 ( cf Interactions). La voie métabolique principale inclut une N-débutylation formant le principal métabolite actif circulant suivi d'une oxydation et d'une désamination oxydative, formant le métabolite inactif, l'acide propanoïque, suivie d'une oxydation et enfin d'une oxydation directe. Les monoamines oxydases participent partiellement au métabolisme du métabolite actif de la dronédarone ( cf Interactions). Le métabolite N-débutylé présente une activité pharmacodynamique mais trois à dix fois moins puissante que celle de la dronédarone. Ce métabolite contribue à l'activité pharmacologique de la dronédarone chez l'homme.
Élimination : Après administration orale, environ 6 % de la dose marquée est excrétée dans l'urine principalement sous forme de métabolites (aucun produit inchangé n'est excrété dans l'urine) et 84 % sont excrétés dans les fèces principalement sous forme de métabolites. Après administration intraveineuse, la clairance plasmatique de la dronédarone est comprise entre 130 et 150 l/h. La demi-vie d'élimination finale de la dronédarone est d'environ 25 à 30 heures et celle de son métabolite N-débutylé d'environ 20 à 25 heures. Chez les patients, la dronédarone et son métabolite sont complètement éliminés du plasma au cours des 2 semaines suivant l'arrêt du traitement à 400 mg deux fois par jour.
Populations spécifiques : La pharmacocinétique de la dronédarone chez des patients ayant une fibrillation auriculaire est cohérente avec celle des sujets sains. Le sexe, l'âge et le poids sont des facteurs qui influencent la pharmacocinétique de la dronédarone. Chacun de ces facteurs a une influence limitée sur la dronédarone.
- Sexe : chez la femme, l'exposition à la dronédarone et à son métabolite N-débutylé est en moyenne 1,3 à 1,9 fois plus élevée que chez l'homme.
- Sujet âgé : sur l'ensemble des sujets inclus dans les études cliniques de la dronédarone, 73 % avaient 65 ans et plus, et 34 % avaient 75 ans et plus. Chez des patients âgés de 65 ans et plus, l'exposition à la dronédarone était plus élevée de 23 % par rapport à celle des patients de moins de 65 ans.
- Insuffisance hépatique : chez des sujets présentant une insuffisance hépatique modérée, l'exposition à la dronédarone libre est multipliée par deux. Celle du métabolite actif est diminuée de 47 % . L'effet de l'insuffisance hépatique sévère sur la pharmacocinétique de la dronédarone n'a pas été évalué .
- Insuffisance rénale : l'effet de l'insuffisance rénale sur la pharmacocinétique de la dronédarone n'a pas été évalué par une étude spécifique. On ne s'attend pas à ce qu'une insuffisance rénale modifie la pharmacocinétique de la dronédarone du fait qu'il n'y a pas d'excrétion urinaire de produit inchangé et que seulement environ 6 % de la dose sont excrétés dans l'urine sous forme de métabolites .
Indications - DRONÉDARONE - usage systémique
DRONÉDARONE est indiqué pour le maintien du rythme sinusal après une cardioversion réussie chez les patients adultes cliniquement stables atteints de fibrillation auriculaire (FA) paroxystique ou persistante. En raison de son profil de tolérance ( cf Contre-indications, Mises en garde et Précautions d'emploi), DRONÉDARONE ne doit être prescrit qu'après avoir envisagé les alternatives thérapeutiques. DRONÉDARONE ne doit pas être administré aux patients ayant une dysfonction systolique du ventricule gauche, ou aux patients avec un antécédent ou présentant un épisode d'insuffisance cardiaque.
On ne sait pas si l'élimination de la dronédarone et/ou de ses métabolites peut être obtenue par dialyse (hémodialyse, dialyse péritonéale ou hémofiltration). Il n'existe pas d'antidote spécifique disponible. En cas de surdosage, un traitement symptomatique devra être instauré en vue de traiter les symptômes.
Grossesse :Il n'existe pas de données ou il existe des données limitées sur l'utilisation de la
dronédarone chez la femme enceinte. Les études chez l'animal ont montré une toxicité sur la reproduction . DRONÉDARONE n'est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception.
Allaitement :On ne sait pas si la dronédarone et ses métabolites sont excrétés dans le lait maternel. Les données pharmacodynamiques et toxicologiques disponibles chez l'animal ont mis en évidence l'excrétion de la dronédarone et de ses métabolites dans le lait. Un risque pour les nouveau-nés et les nourrissons ne peut être exclu.
Une décision doit être prise soit d'interrompre l'allaitement, soit d'interrompre/de s'abstenir du traitement avec DRONÉDARONE en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité :Les études chez l'animal n'ont pas mis en évidence d'altération de la fertilité avec dronédarone.

 Français
Français Русский
Русский