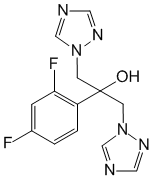
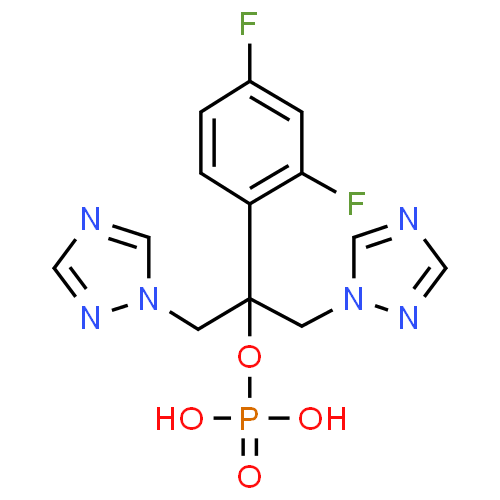
Pharmacodynamique
Le fluconazole fait partie de la classe triazole des agents antifongiques avec des effets principalement fongistatiques. C'est un inhibiteur puissant et sélectif de la synthèse de l'ergostérol fongique, responsable des lésions de la membrane cellulaire.
Le fluconazole est hautement spécifique des enzymes des cytochromes P450 fongiques.
Mécanisme de résistance
Selon les espèces de levure impliquées, les principaux mécanismes de résistance au fluconazole, communs aux autres agents antifongiques azolés, entraînent une réduction de l'accumulation du médicament dans la cellule (i) en modifiant la composition en acides aminés du lanostérol 14α-demethylase, (ii) en augmentant le flux du médicament, et (iii) en altérant les voies de biosynthèse de l'ergostérol. Avec Candida albicans, l'inhibition des voies de biosynthèse de l'ergostérol semble aboutir principalement à l'inhibition du C5,6-desaturase, codée par ERG3. Dans l'espèce la plus résistante, Candida glabrata, la voie prédominante n'a pas été entièrement élucidée mais il semble que cela pourrait résulter d'une augmentation de la régulation des gènes CDR (CDR1, CDR2 et MMDR1) responsables du flux cellulaire de la substance médicamenteuse. Une résistance au fluconazole entraîne donc habituellement une résistance aux autres agents antifongiques azolés.
Avec Cryptococcus neoformans, des études ont montré que les mêmes principaux mécanismes de résistance existent dans cette espèce, par exposition antérieure aux agents antifongiques azolés.
Il faut considérer attentivement et de manière analogue les bénéfices de la posologie proposée comparé au risque de développement d'une résistance avec le fluconazole comme n'importe quelle autre chimiothérapie antimicrobienne.
Sensibilité antifongique
[Source: Pfaller et al., 2006: ARTEMIS DISK Global Antifungal Surveillance Study.
Messer et al., 2006: SENTRY Antimicrobial Surveillance Program (2003)
Rex JH, 2000: IDSA Practice Guidelines for the Treatment of Candidiasis.]
Le spectre antifongique du fluconazole inclut un certain nombre d'agents pathogènes tels que Candida albicans, et des espèces non Candida albicans, des espèces Cryptococcus et autres dermatophytes.
La prévalence de la résistance acquise peut varier pour certaines espèces géographiquement et avec le temps.
Il est par conséquent souhaitable d'obtenir des informations sur les modes de résistance locale, particulièrement pour un traitement approprié des infections sévères.
Interprétation des seuils pour les espèces de Candida:
| Classification | CMI (μg/ml) | Espèces | Source bibiographique |
Sensibles (S) | Inférieure à 8 | C. albicans, C. parapsilosis, C. lusitaniae, C. kefyr, C. dubliniensis, C. pelliculosa. | Pfaller MA et al., 2006 Messer SA et al., 2006 Rex JH, 2000 |
Sensibilité fonction de la dose (S- DD) | 16 à 32 | C. glabrata (environ 17 % R), C. guillermondii (environ 10 % R), C. famata (environ 12 % R) C. tropicalis (environ 4% R) | Pfaller MA et al., 2006 Messer SA et al., 2006 Rex JH, 2000 |
Résistant (R) | Supérieure à 32 | C. krusei, C. rugosa, C. inconspicua, C. norvegensis, C. lipolytica, C. zeylanoides. | Pfaller MA et al., 2006 Messer SA et al., 2006 Rex JH, 2000 |
Des cas de résistances de Candida albicans survenant chez des patients atteints par le SIDA qui avaient reçu un traitement à long terme au fluconazole ont été rapportés.
Cryptococcus neoformans est principalement sensible au fluconazole. Les souches avec une CMI supérieure à 32 mcg par ml sont considérées comme résistantes.
Le fluconazole a peu ou pas d'action sur les espèces Aspergillus, Zygomycetes, Microsporum et Trychophyton.
Pharmacocinétique
Pharmacocinétique - FLUCONAZOLE - voie orale
Les formes orales et intraveineuses du fluconazole sont équivalentes du point de vue pharmacocinétique.
Absorption
Après administration orale, le fluconazole est bien absorbé et les taux plasmatiques (et la biodisponibilité systémique) représentent plus de 90 % des taux atteints après l'administration intraveineuse. L'absorption orale n'est pas affectée par la prise alimentaire simultanée. Les concentrations plasmatiques maximales à jeun sont atteintes 30 minutes à 1 heure et demie après la prise. Les concentrations plasmatiques sont proportionnelles à la dose. Quatre-vingt-dix % des taux à l'état d'équilibre sont atteints 4‑5 jours après l'administration de doses quotidiennes uniques répétées. L'administration d'une dose de charge (au jour 1) égale au double de la dose habituelle permet aux taux plasmatiques d'approcher de 90 % des taux à l'état d'équilibre au jour 2.
Distribution
Le volume de distribution apparent est proche du volume d'eau corporelle totale. La liaison aux protéines plasmatiques est faible (11‑12 %).
Le fluconazole pénètre bien dans tous les liquides corporels étudiés. Les taux de fluconazole dans la salive et dans l'expectoration sont comparables aux taux plasmatiques. Chez les patients atteints de méningite fongique, les taux de fluconazole dans le LCR représentent environ 80 % des taux plasmatiques correspondants.
Des concentrations élevées de fluconazole, supérieures aux concentrations sériques, sont atteintes dans la couche cornée, l'épiderme et le derme et les glandes sudoripares eccrines. Le fluconazole s'accumule dans la couche cornée. A la dose de 50 mg une fois par jour, la concentration de fluconazole après 12 jours a été de 73 µg/g et, 7 jours après l'arrêt du traitement, la concentration était encore de 5,8 µg/g. A la dose de 150 mg une fois par semaine, la concentration de fluconazole dans la couche cornée au jour 7 était de 23,4 µg/g et 7 jours après la seconde dose, elle était encore de 7,1 µg/g.
La concentration de fluconazole dans les ongles après 4 mois de traitement par 150 mg une fois par semaine a été de 4,05 µg/g dans les ongles sains et de 1,8 µg/g dans les ongles malades ; et le fluconazole était toujours mesurable dans les ongles 6 mois après la fin du traitement.
Biotransformation
Le fluconazole n'est que faiblement métabolisé. Seulement 11 % d'une dose radioactive sont éliminés dans l'urine sous forme de métabolites. Le fluconazole est un inhibiteur modéré des isoenzymes CYP2C9 et CYP3A4 . Le fluconazole est également un inhibiteur puissant de l'isoenzyme CYP2C19.
Élimination
La demi-vie d'élimination plasmatique du fluconazole est d'environ 30 heures. La principale voie d'élimination est rénale, environ 80 % de la dose administrée étant éliminés dans l'urine sous forme inchangée. La clairance du fluconazole est proportionnelle à la clairance de la créatinine. Aucun métabolite circulant n'a été mis en évidence.
La longue demi-vie d'élimination plasmatique permet l'administration de doses uniques pour le traitement de la candidose vaginale, de doses uniques quotidiennes et de doses uniques hebdomadaires dans les autres indications.
Pharmacocinétique chez l'insuffisant rénal
Chez les patients présentant une insuffisance rénale sévère (avec un débit de filtration glomérulaire DFG < 20 ml/min), la demi-vie est passée de 30 à 98 heures. Une réduction de la dose est donc nécessaire. Le fluconazole est éliminé par hémodialyse et, dans une moindre mesure, par dialyse péritonéale. Après une séance d'hémodialyse de 3 heures, environ 50 % du fluconazole sont éliminés du sang.
Pharmacocinétique durant l'allaitement
Une étude pharmacocinétique chez dix femmes allaitantes, ayant arrêté partiellement ou totalement l'allaitement de leur nourrisson, a évalué les concentrations de fluconazole dans le plasma et dans le lait maternel, pendant 48 heures, après l'administration d'une dose unique de 150 mg de FLUCONAZOLE. Le fluconazole a été détecté dans le lait maternel à une concentration moyenne d'environ 98 % de celle du plasma de la mère. La concentration maximale moyenne dans le lait était de 2,61 mg/l, 5,2 heures après administration. L'ingestion quotidienne moyenne, estimée, de fluconazole par le nourrisson lors de l'allaitement (consommation moyenne de lait supposée de 150 ml/kg/j) basée sur la concentration maximale moyenne dans le lait, est de 0,39 mg/kg/j, soit environ 40 % de la dose néonatale recommandée (nourrisson < 2 semaines) ou 13 % de la dose recommandée chez le nourrisson pour une candidose des muqueuses.
Pharmacocinétique chez l'enfant
Les données pharmacocinétiques ont été évaluées chez 113 enfants ayant participé à 5 études ; 2 études à doses uniques, 2 études à doses répétées et 1 étude chez des prématurés. Les données d'une étude n'étaient pas interprétables en raison de modifications de la formulation au cours de l'étude. Des données supplémentaires étaient disponibles, provenant d'une étude en usage compassionnel.
Après l'administration de 2‑8 mg/kg de fluconazole à des enfants âgés de 9 mois à 15 ans, une ASC d'environ 38 µg.h/ml a été trouvée par unités de dose de 1 mg/kg. La demi-vie d'élimination plasmatique moyenne du fluconazole a été comprise entre 15 et 18 heures et le volume de distribution a été d'environ 880 ml/kg après l'administration de doses répétées. Une demi-vie d'élimination plasmatique du fluconazole plus élevée, d'environ 24 heures, a été retrouvée après l'administration d'une dose unique. Cela est comparable à la demi-vie d'élimination plasmatique du fluconazole après l'administration d'une dose unique de 3 mg/kg IV à des enfants âgés de 11 jours à 11 mois. Le volume de distribution dans ce groupe d'âge a été d'environ 950 ml/kg.
L'expérience du fluconazole chez le nouveau-né se limite à des études pharmacocinétiques chez des prématurés. L'âge moyen au moment de l'administration de la première dose était de 24 heures (extrêmes 9‑36 heures) et le poids de naissance moyen était de 0,9 kg (extrêmes 0,75‑1,10 kg) pour 12 prématurés d'âge gestationnel moyen d'environ 28 semaines. Sept patients ont terminé l'étude ; 5 perfusions intraveineuses de 6 mg/kg de fluconazole au maximum ont été administrées toutes les 72 heures. La demi-vie moyenne (heures) a été de 74 (extrêmes 44-185) au jour 1 et elle a diminué, avec le temps, à 53 (extrêmes 30‑131) au jour 7 et à 47 (extrêmes 27‑68) au jour 13. L'aire sous la courbe (µg.h/ml) a été de 271 (extrêmes 173‑385) au jour 1 et elle a augmenté à 490 (extrêmes 292‑734) au jour 7 et diminué à 360 (extrêmes 167-566) au jour 13. Le volume de distribution (ml/kg) a été de 1 183 (extrêmes 1 070‑1 470) au jour 1 et il a augmenté, avec le temps, à 1 184 (extrêmes 510‑2 130) au jour 7 et à 1 328 (extrêmes 1 040‑1 680) au jour 13.
Pharmacocinétique chez le sujet âgé
Une étude pharmacocinétique a été conduite chez 22 sujets, âgés de 65 ans et plus, traités par une dose orale unique de 50 mg de fluconazole. Dix de ces patients recevaient simultanément des diurétiques. La Cmax a été de 1,54 µg/ml et elle a été atteinte 1,3 heure après la prise. L'ASC moyenne a été de 76,4 ± 20,3 µg.h/ml et la demi-vie d'élimination terminale moyenne a été de 46,2 heures. Ces valeurs des paramètres pharmacocinétiques sont plus élevées que les valeurs correspondantes rapportées chez des volontaires sains jeunes de sexe masculin. La coadministration de diurétiques n'a modifié de manière significative ni l'ASC ni la Cmax. De plus, les valeurs de la clairance de la créatinine (74 ml/min), du pourcentage de médicament retrouvé dans l'urine sous forme inchangée (0‑24 h, 22 %) et de la clairance rénale du fluconazole (0,124 ml/min/kg) ont généralement été plus faibles chez les sujets âgés que chez les volontaires plus jeunes. L'altération de l'élimination du fluconazole chez les sujets âgés semble donc être liée à la réduction de la fonction rénale caractéristique de ce groupe.
Pharmacocinétique - FLUCONAZOLE - usage parentéral
Absorption
Les propriétés pharmacocinétiques du fluconazole sont semblables après une administration par voie intraveineuse ou orale.
Le fluconazole est bien absorbé par voie orale. La biodisponibilité absolue est supérieure à 90 %. L'absorption par voie orale n'est pas affectée par la prise alimentaire simultanée. La concentration plasmatique maximale à jeun est atteinte 30 minutes à 1 heure et demie après la prise. 90 % du niveau à l'état d'équilibre est atteint 4-5 jours après dosage une fois par jour.
La concentration plasmatique est proportionnelle à la dose. Après administration de 200 mg de fluconazole, la Cmax se situe autour de 4,6 mg/l et les concentrations plasmatiques à l'état d'équilibre après 15 jours se situent autour de 10 mg/l. Après administration de 400 mg de fluconazole, la Cmax est d'environ 9 mg/l et les concentrations plasmatiques à l'état d'équilibre après 15 jours se situent autour de 18 mg/l. La prise d'une double dose à J1 induit des concentrations plasmatiques d'environ 90 % du niveau à l'état d'équilibre à J2.
Distribution
Le volume apparent de distribution de fluconazole correspond à la totalité du volume aqueux contenu dans le corps. Le taux de fixation aux protéines plasmatiques est faible (11-12 %).
Le fluconazole présente une bonne pénétration dans tous les fluides corporels étudiés. Les concentrations de fluconazole dans la salive et le crachat correspondent aux concentrations plasmatiques. Chez les patients atteints de méningite fongique, les concentrations de fluconazole dans le liquide céphalorachidien représentent environ 80 % des concentrations plasmatiques correspondantes.
Le fluconazole se retrouve à des taux supérieurs au niveau de la cornée, de l'épiderme, du derme et des glandes sudoripares qu'au niveau du sérum. Le fluconazole s'accumule dans la cornée. Par exemple, à une dose de 150 mg une fois par semaine, la concentration de fluconazole dans la cornée représente 23,3 mcg/g après 2 doses et 7 jours après la fin du traitement, se situe encore autour de 7,1 mcg/g.
Biotransformation
La dégradation du fluconazole est limitée. Seuls 11 % d'une dose radioactive sont excrétés dans l'urine sous forme de métabolites.
Elimination
La principale voie d'élimination est rénale. Environ 80 % de la dose éliminée sont excrétés dans les urines sans avoir été métabolisée. La clairance du fluconazole est proportionnelle à la clairance à la créatinine. Aucun métabolite circulant n'a été mis en évidence.
La demi-vie plasmatique moyenne est de 30 heures environ. La longue demi-vie plasmatique permet le traitement en doses uniques journalières, pour toutes les indications.
Propriétés pharmacocinétiques chez les enfants
Les enfants éliminent le fluconazole plus rapidement que les adultes.
Chez les enfants (après la période néonatale) et les adolescents de 5 et 15 ans, la demi-vie plasmatique est comprise entre 15,2 et 17,6 heures.
Les bébés prématurés ont une demi-vie plasmatique plus courte (70 heures environ) et un volume de distribution plus important (1,2-2,3 litres/kg) que les bébés nés à terme. Dans la semaine suivant la naissance et au cours de la période néonatale, la clairance plasmatique du fluconazole augmente (et la demi-vie plasmatique chute).
Les propriétés pharmacocinétiques du fluconazole n'ont pas été étudiées chez les enfants souffrant d'insuffisance rénale.
Dosage
Dosage - FLUCONAZOLE - voie orale
Gélule
La dose devra être basée sur la nature et la sévérité de l'infection fongique. Le traitement des infections nécessitant des administrations répétées doit être poursuivi jusqu'à ce que les paramètres cliniques ou les analyses de laboratoire indiquent que l'infection fongique active a régressé. Une période inadéquate de traitement peut entraîner la récidive de l'infection active.
Adultes
Indications | Posologie | Durée du traitement |
Cryptococcose | - Traitement des méningites à cryptocoques. | Dose de charge : 400 mg le premier jour Dose suivante : 200 mg à 400 mg une fois par jour | Habituellement au moins 6 à 8 semaines. Dans les infections menaçant le pronostic vital, la dose quotidienne peut être augmentée à 800 mg. |
- Traitement d'entretien pour prévenir une rechute de méningite à cryptocoques chez les patients avec un risque élevé de récidive. | 200 mg une fois par jour | Durée indéterminée à une dose quotidienne de 200 mg. |
Coccidioïdomycose | | 200 mg à 400 mg une fois par jour | 11 mois jusqu'à 24 mois ou plus, en fonction du patient. Une dose de 800 mg par jour peut être envisagée pour certaines infections et notamment en cas d'atteinte méningée. |
Candidose invasive |
| Dose de charge : 800 mg le premier jour Dose suivante: 400 mg une fois par jour | En règle générale, la durée recommandée du traitement de la candidémie est de 2 semaines après le premier résultat d'hémoculture négatif et après la résolution des signes et symptômes attribuables à la candidémie. |
Traitement de la candidose des muqueuses | - Candidose oropharyngée | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg une fois par jour | 7 à 21 jours (jusqu'à la rémission de la candidose oropharyngée) Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose sophagienne | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg une fois par jour | 14 à 30 jours (jusqu'à la rémission de la candidose sophagienne). Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidurie | 200 mg à 400 mg une fois par jour | 7 à 21 jours. Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose atrophique chronique | 50 mg une fois par jour | 14 jours |
- Candidose cutanéo-muqueuse chronique | 50 mg à 100 mg une fois par jour | Jusqu'à 28 jours. Périodes plus longues en fonction de la sévérité de l'infection et de l'immunosuppression sous-jacente et de l'infection. |
Prévention de rechute d'une candidose des muqueuses chez les patients infectés par le VIH présentant un haut risque de récidive | - Candidose oropharyngée | 100 à 200 mg par une fois jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
- Candidose sophagienne | 100 mg à 200 mg une fois par jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
Candidose génitale
| - Candidose vaginale aiguë - Balanite candidosique | 150 mg | Dose unique. |
- Traitement et prévention des candidoses vaginales récidivantes (4 épisodes par an ou plus). | 150 mg tous les 3 jours à raison de 3 doses au total (J1, J4 et J7), suivis d'une dose d'entretien de 150 mg une fois par semaine | Dose d'entretien : 6 mois. |
Dermatomycose | - tinea pedis, - tinea corporis, - tinea cruris, - infections à Candida | 150 mg une fois par semaine ou 50 mg une fois par jour | 2 à 4 semaines, tinea pedis peut nécessiter un traitement allant jusqu'à 6 semaines. |
- tinea versicolor | 300 mg à 400 mg une fois par semaine | 1 à 3 semaines. |
50 mg une fois par jour | 2 à 4 semaines. |
- tinea unguium (onychomycose) | 150 mg une fois par semaine | Le traitement doit être poursuivi jusqu'au remplacement de l'ongle infecté (repousse d'un ongle non infecté). La repousse des ongles des doigts et des ongles des orteils nécessite normalement respectivement 3 à 6 mois et 6 à 12 mois. Les taux de croissance peuvent toutefois varier de manière importante entre individus et en fonction de l'âge. Après le succès de ce traitement de longue durée de ces infections chroniques, les ongles peuvent parfois rester déformés. |
Prophylaxie des infections à Candida chez les patients atteints de neutropénie prolongée | | 200 mg à 400 mg une fois par jour | Le traitement doit débuter plusieurs jours avant le début de la neutropénie induite et se poursuivre 7 jours après la résolution de la neutropénie (taux de neutrophiles supérieur à 1 000 cellules par mm3). |
Populations particulières
Sujets âgés
La posologie doit être ajustée sur la base de la fonction rénale (voir « Insuffisance rénale »).
Insuffisance rénale
FLUCONAZOLE est majoritairement excrété dans les urines sous forme inchangée. Lors du traitement à dose unique, aucun ajustement de la posologie n'est nécessaire. Chez les patients (y compris les enfants) présentant une altération de la fonction rénale qui recevront des doses répétées de fluconazole, une dose initiale de 50 mg à 400 mg doit être administrée, en fonction de la posologie normale recommandée dans l'indication concernée. Après cette dose de charge initiale, la dose quotidienne (selon l'indication) doit être ajustée selon le tableau suivant :
Clairance de la créatinine (ml/min) | Pourcentage de la dose recommandée |
> 50 | 100 % |
≤ 50 (pas d'hémodialyse) | 50 % |
Hémodialyse | 100 % après chaque hémodialyse |
Les patients en hémodialyse doivent recevoir 100 % de la dose recommandée après chaque hémodialyse ; les jours de non-dialyse, les patients doivent recevoir une dose réduite en fonction de leur clairance de la créatinine.
Insuffisance hépatique
Les données disponibles chez les patients présentant une insuffisance hépatique sont limitées, le fluconazole doit donc être administré avec prudence chez les patients présentant une altération de la fonction hépatique .
Population pédiatrique
Une posologie maximale de 400 mg par jour ne doit pas être dépassée dans la population pédiatrique.
Comme dans les infections similaires chez l'adulte, la durée du traitement est basée sur la réponse clinique et mycologique. FLUCONAZOLE est administré en une prise unique quotidienne.
La pharmacocinétique du fluconazole n'a pas été étudiée dans la population pédiatrique présentant une insuffisance rénale (pour les « nouveau-nés à terme » qui présentent souvent une immaturité rénale primaire, veuillez voir ci-dessous).
Nourrissons, jeunes enfants et enfants (âgés de 28 jours à 11 ans) :
Indication | Posologie | Recommandations |
- Candidose des muqueuses | Dose initiale : 6 mg/kg Dose suivante : 3 mg/kg une fois par jour | La dose initiale peut être utilisée le premier jour afin d'atteindre plus rapidement les taux à l'état d'équilibre |
- Candidose invasive - Méningite à cryptocoques | Dose : 6 à 12 mg/kg une fois par jour | En fonction de la sévérité de la maladie |
- Traitement d'entretien pour prévenir les rechutes de la méningite à cryptocoques chez les enfants présentant un risque élevé de récidive | Dose : 6 mg/kg une fois par jour | En fonction de la sévérité de la maladie |
- Prophylaxie des infections à Candida chez les patients immunodéprimés | Dose : 3 à 12 mg/kg une fois par jour | En fonction de l'importance et de la durée de la neutropénie induite (voir posologie chez l'adulte) |
Adolescents (âgés de 12 à 17 ans) :
Le prescripteur déterminera la posologie la plus appropriée (adultes ou enfants) en fonction du poids et du développement pubère de l'adolescent. Les données cliniques indiquent que les enfants ont une clairance du fluconazole plus élevée que celle observée chez les adultes. Une dose de 100, 200 et 400 mg chez l'adulte correspond à une dose de 3, 6 et 12 mg/kg chez l'enfant pour obtenir une exposition systémique comparable.
La sécurité et l'efficacité dans l'indication candidose génitale dans la population pédiatrique n'ont pas été établies. Si le traitement est impératif pour la candidose génitale chez les adolescents (12 à 17 ans), la posologie doit être la même que celle chez les adultes.
Nouveau-nés à terme (âgés de 0 à 27 jours) :
Les nouveau-nés éliminent lentement le fluconazole. On dispose de peu de données pharmacocinétiques à l'appui de cette posologie chez les nouveau-nés à terme .
Groupe d'âge | Posologie | Recommandations |
Nouveau-né à terme (0 à 14 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 72 heures | Une posologie maximale de 12 mg/kg toutes les 72 heures ne doit pas être dépassée |
Nouveau-né à terme (15 à 27 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 48 heures | Une posologie maximale de 12 mg/kg toutes les 48 heures ne doit pas être dépassée |
Mode d'administration
FLUCONAZOLE peut être administré soit par voie orale (gélules et poudre pour suspension buvable) soit par perfusion intraveineuse (solution pour perfusion), la voie d'administration dépendant de l'état clinique du patient. Lors du passage de la voie intraveineuse à la voie orale, ou vice versa, il n'est pas nécessaire de modifier la dose quotidienne.
Le médecin doit prescrire la forme pharmaceutique et le dosage les plus appropriés en fonction de l'âge, du poids et de la posologie. La forme gélule n'est pas adaptée à un usage chez les nourrissons et les jeunes enfants. Des formes liquides buvables de fluconazole sont disponibles et sont mieux adaptées à cette population.
Les gélules doivent être avalées entières, au cours ou en dehors des repas.
Poudre pour suspension buvable
La dose devra être basée sur la nature et la sévérité de l'infection fongique. Le traitement des infections nécessitant des administrations répétées doit être poursuivi jusqu'à ce que les paramètres cliniques ou les analyses de laboratoire indiquent que l'infection fongique active a régressé. Une période inadéquate de traitement peut entraîner la récidive de l'infection active.
Adultes
Indications | Posologie | Durée du traitement |
Cryptococcose | - Traitement des méningites à cryptocoques. | Dose de charge : 400 mg le premier jour Dose suivante : 200 mg à 400 mg par jour | Habituellement au moins 6 à 8 semaines. Dans les infections menaçant le pronostic vital, la dose quotidienne peut être augmentée à 800 mg. |
- Traitement d'entretien pour prévenir une rechute de méningite à cryptocoques chez les patients avec un risque élevé de récidive. | 200 mg par jour | Durée indéterminée à une dose quotidienne de 200 mg. |
Coccidioïdomycose | | 200 mg à 400 mg | 11 mois jusqu'à 24 mois ou plus, en fonction du patient. Une dose de 800 mg par jour peut être envisagée pour certaines infections et notamment en cas d'atteinte méningée. |
Candidose invasive | | Dose de charge : 800 mg le premier jour Dose suivante : 400 mg par jour | En règle générale, la durée recommandée du traitement de la candidémie est de 2 semaines après le premier résultat d'hémoculture négatif et après la résolution des signes et symptômes attribuables à la candidémie. |
Traitement de la candidose des muqueuses | - Candidose oropharyngée | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg par jour | 7 à 21 jours (jusqu'à la rémission de la candidose oropharyngée) Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose sophagienne | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg par jour | 14 à 30 jours (jusqu'à la rémission de la candidose sophagienne). Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidurie | 200 mg à 400 mg par jour | 7 à 21 jours. Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose atrophique chronique | 50 mg par jour | 14 jours |
- Candidose cutanéo-muqueuse chronique | 50 mg à 100 mg par jour | Jusqu'à 28 jours. Périodes plus longues en fonction de la sévérité de l'infection et de l'immunosuppression sous-jacente et de l'infection. |
Prévention de rechute d'une candidose des muqueuses chez les patients infectés par le VIH présentant un haut risque de récidive | - Candidose oropharyngée | 100 à 200 mg par jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
- Candidose sophagienne | 100 mg à 200 mg par jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
Candidose génitale | - Candidose vaginale aiguë - Balanite candidosique | 150 mg | Dose unique. |
- Traitement et prévention des candidoses vaginales récidivantes (4 épisodes par an ou plus). | 150 mg tous les 3 jours à raison de 3 doses au total (J1, J4 et J7), suivis d'une dose d'entretien de 150 mg une fois par semaine | Dose d'entretien : 6 mois. |
Dermatomycose | - tinea pedis, - tinea corporis, - tinea cruris, - infections à Candida | 150 mg une fois par semaine ou 50 mg une fois par jour | 2 à 4 semaines, tinea pedis peut nécessiter un traitement allant jusqu'à 6 semaines. |
- tinea versicolor | 300 mg à 400 mg une fois par semaine | 1 à 3 semaines. |
50 mg une fois par jour | 2 à 4 semaines. |
- tinea unguium (onychomycose) | 150 mg une fois par semaine | Le traitement doit être poursuivi jusqu'au remplacement de l'ongle infecté (repousse d'un ongle non infecté). La repousse des ongles des doigts et des ongles des orteils nécessite normalement respectivement 3 à 6 mois et 6 à 12 mois. Les taux de croissance peuvent toutefois varier de manière importante entre individus et en fonction de l'âge. Après le succès de ce traitement de longue durée de ces infections chroniques, les ongles peuvent parfois rester déformés. |
Prophylaxie des infections à Candida chez les patients atteints de neutropénie prolongée | | 200 mg à 400 mg | Le traitement doit débuter plusieurs jours avant le début de la neutropénie induite et se poursuivre 7 jours après la résolution de la neutropénie (taux de neutrophiles supérieur à 1000 cellules par mm3). |
Populations particulières
Sujets âgés
La posologie doit être ajustée sur la base de la fonction rénale (voir « Insuffisance rénale»).
Insuffisance rénale
Lors du traitement à dose unique, aucun ajustement de la posologie n'est nécessaire. Chez les patients (y compris les enfants) présentant une altération de la fonction rénale qui recevront des doses répétées de fluconazole, une dose initiale de 50 mg à 400 mg doit être administrée, en fonction de la posologie normale recommandée dans l'indication concernée. Après cette dose de charge initiale, la dose quotidienne (selon l'indication) doit être ajustée selon le tableau suivant :
Clairance de la créatinine (ml/min) | Pourcentage de la dose recommandée |
>50 | 100 % |
≤50 (pas de dialyse) | 50 % |
Dialyse régulière | 100 % après chaque dialyse |
Les patients en dialyse régulière doivent recevoir 100% de la dose recommandée après chaque dialyse; les jours de non-dialyse, les patients doivent recevoir une dose réduite en fonction de leur clairance de la créatinine.
Insuffisance hépatique
Les données disponibles chez les patients présentant une insuffisance hépatique sont limitées, le fluconazole doit donc être administré avec prudence chez les patients présentant une altération de la fonction hépatique .
Population pédiatrique
Une posologie maximale de 400 mg par jour ne doit pas être dépassée dans la population pédiatrique.
Comme dans les infections similaires chez l'adulte, la durée du traitement est basée sur la réponse clinique et mycologique.
FLUCONAZOLE est administré en une prise unique quotidienne.
Toutefois, la fréquence d'administration est différente chez le nouveau-né à terme (voir ci-dessous).
La pharmacocinétique du fluconazole n'a pas été étudiée dans la population pédiatrique présentant une insuffisance rénale (pour les « nouveau-nés à terme » qui présentent souvent une immaturité rénale primaire, veuillez voir ci-dessous).
Nourrissons, jeunes enfants et enfants (âgés de 28 jours à 11 ans) :
Indication | Posologie | Recommandations |
- Candidose des muqueuses | Dose initiale : 6 mg/kg Dose suivante : 3 mg/kg par jour | La dose initiale peut être utilisée le premier jour afin d'atteindre plus rapidement les taux à l'état d'équilibre |
- Candidose invasive - Méningite à cryptocoques | Dose : 6 à 12 mg/kg par jour | En fonction de la sévérité de la maladie |
- Traitement d'entretien pour prévenir les rechutes de la méningite à cryptocoques chez les enfants présentant un risque élevé de récidive | Dose : 6 mg/kg par jour | En fonction de la sévérité de la maladie |
- Prophylaxie des infections à Candida chez les patients immunodéprimés | Dose : 3 à 12 mg/kg par jour | En fonction de l'importance et de la durée de la neutropénie induite (voir posologie chez l'adulte) |
Adolescents (âgés de 12 à 17 ans) :
Le prescripteur déterminera la posologie la plus appropriée (adultes ou enfants) en fonction du poids et du développement pubère de l'adolescent. Les données cliniques indiquent que les enfants ont une clairance du fluconazole plus élevée que celle observée chez les adultes. Une dose de 100, 200 et 400 mg chez l'adulte correspond à une dose de 3, 6 et 12 mg/kg chez l'enfant pour obtenir une exposition systémique comparable.
La sécurité et l'efficacité dans l'indication candidose génitale dans la population pédiatrique n'ont pas été établies. Si le traitement est impératif pour la candidose génitale chez les adolescents (12 à 17 ans), la posologie doit être la même que la posologie chez les adultes.
Nouveau-nés à terme (âgés de 0 à 27 jours) :
Les nouveau-nés éliminent lentement le fluconazole. On dispose de peu de données pharmacocinétiques à l'appui de cette posologie chez les nouveau-nés à terme .
Groupe d'âge | Posologie | Recommandations |
Nouveau-né à terme (0 à 14 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 72 heures | Une posologie maximale de 12 mg/kg toutes les 72 heures ne doit pas être dépassée |
Nouveau-né à terme (15 à 27 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 48 heures | Une posologie maximale de 12 mg/kg toutes les 48 heures ne doit pas être dépassée |
Mode d'administration
FLUCONAZOLE peut être administré soit par voie orale soit par perfusion intraveineuse, la voie d'administration dépendant de l'état clinique du patient. Lors du passage de la voie intraveineuse à la voie orale, ou vice versa, il n'est pas nécessaire de modifier la dose quotidienne.
FLUCONAZOLE peut être pris avec ou sans nourriture.
Pour les instructions relatives à la reconstitution de la poudre pour suspension buvable . La suspension reconstituée sera une suspension blanche à blanc cassé au goût d'orange.
Chez les patients adultes, calculer la dose à administrer en ml/jour en fonction de la posologie en mg/jour recommandée et du dosage du produit.
Pour la fréquence d'administration en fonction de l'âge du patient, consulter les tableaux indiquant la posologie ci-dessus.
Dosage - FLUCONAZOLE - usage parentéral
Solution pour perfusion
La dose devra être basée sur la nature et la sévérité de l'infection fongique. Le traitement des infections nécessitant des administrations répétées doit être poursuivi jusqu'à ce que les paramètres cliniques ou les analyses de laboratoire indiquent que l'infection fongique active a régressé. Une période inadéquate de traitement peut entraîner la récidive de l'infection active.
Adultes
Indications | Posologie | Durée de traitement |
Cryptococcose | -Traitement des méningites à cryptocoques. | Dose de charge : 400 mg le premier jour Dose suivante : 200 mg à 400 mg une fois par jour | Habituellement d'au moins 6 à 8 semaines. Dans les infections menaçant le pronostic vital, la dose quotidienne peut être augmentée à 800 mg. |
- Traitement d'entretien pour prévenir une rechute de méningite à cryptocoques chez les patients avec un risque élevé de récidive. | 200 mg une fois par jour | Durée indéterminée à une dose quotidienne de 200 mg. |
Coccidioïdomycose | | 200 mg à 400 mg une fois par jour | 11 mois jusqu'à 24 mois ou plus, en fonction du patient. Une dose de 800 mg par jour peut être envisagée pour certaines infections et notamment en cas d'atteinte méningée. |
Candidose invasive | | Dose de charge : 800 mg le premier jour Dose suivante : 400 mg une fois par jour | En règle générale, la durée recommandée du traitement de la candidémie est de 2 semaines après le premier résultat d'hémoculture négatif et après la résolution des signes et symptômes attribuables à la candidémie. |
Traitement de la candidose des muqueuses | - Candidose oropharyngée | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg une fois par jour | 7 à 21 jours (jusqu'à la rémission de la candidose oropharyngée). Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose sophagienne | Dose de charge : 200 mg à 400 mg le premier jour Dose suivante : 100 mg à 200 mg une fois par jour | 14 à 30 jours (jusqu'à la rémission de la candidose sophagienne). Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidurie | 200 mg à 400 mg une fois par jour | 7 à 21 jours. Des périodes plus longues peuvent être utilisées chez les patients sévèrement immunodéprimés. |
- Candidose atrophique chronique | 50 mg une fois par jour | 14 jours. |
- Candidose cutanéo-muqueuse chronique | 50 mg à 100 mg une fois par jour | Jusqu'à 28 jours. Périodes plus longues en fonction de la sévérité de l'infection et de l'immunosuppression sous-jacente et de l'infection. |
Prévention de rechute d'une candidose des muqueuses chez les patients infectés par le VIH présentant un haut risque de récidive | - Candidose oropharyngée | 100 mg à 200 mg une fois par jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
- Candidose sophagienne | 100 mg à 200 mg une fois par jour ou 200 mg 3 fois par semaine. | Période indéterminée chez les patients avec une immunosuppression chronique. |
Prophylaxie des infections à Candida chez les patients atteints de neutropénie prolongée | | 200 mg à 400 mg une fois par jour | Le traitement doit débuter plusieurs jours avant le début de la neutropénie induite et se poursuivre 7 jours après la résolution de la neutropénie (taux de neutrophiles supérieur à 1000 cellules par mm3). |
Populations particulières
Sujets âgés
La posologie doit être ajustée sur la base de la fonction rénale (voir « Insuffisance rénale »).
Insuffisance rénale
FLUCONAZOLE est principalement éliminé dans l'urine sous forme inchangée. Lors du traitement à dose unique, aucun ajustement de la posologie n'est nécessaire. Chez les patients (y compris les enfants) présentant une altération de la fonction rénale qui recevront des doses répétées de fluconazole, une dose initiale de 50 mg à 400 mg doit être administrée, en fonction de la posologie normale recommandée dans l'indication concernée. Après cette dose de charge initiale, la dose quotidienne (selon l'indication) doit être ajustée selon le tableau suivant.
Clairance de la créatinine (ml/min) | Pourcentage de la dose recommandée |
>50 | 100 % |
≤50 (pas d'hémodialyse) | 50 % |
Dialyse régulière | 100 % après chaque hémodialyse |
Les patients en hémodialyse régulière doivent recevoir 100% de la dose recommandée après chaque hémodialyse; les jours de non-dialyse, les patients doivent recevoir une dose réduite en fonction de leur clairance de la créatinine.
Insuffisance hépatique
Les données disponibles chez les patients présentant une insuffisance hépatique sont limitées, le fluconazole doit donc être administré avec prudence chez les patients présentant une altération de la fonction hépatique .
Population pédiatrique
Une posologie maximale de 400 mg par jour ne doit pas être dépassée dans la population pédiatrique.
Comme dans les infections similaires chez l'adulte, la durée du traitement est basée sur la réponse clinique et mycologique. FLUCONAZOLE est administré en une prise unique quotidienne.
La pharmacocinétique du fluconazole n'a pas été étudiée dans la population pédiatrique présentant une insuffisance rénale (pour les « nouveau-nés à terme » qui présentent souvent une immaturité rénale primaire, veuillez voir ci-dessous).
Nourrissons, jeunes enfants et enfants (âgés de 28 jours à 11 ans) :
Indication | Posologie | Recommandations |
- Candidose des muqueuses | Dose initiale : 6 mg/kg Dose suivante : 3 mg/kg une fois par jour | La dose initiale peut être utilisée le premier jour afin d'atteindre plus rapidement les taux à l'état d'équilibre. |
- Candidose invasive - Méningite à cryptocoques | Dose : 6 à 12 mg/kg une fois par jour | En fonction de la sévérité de la maladie. |
- Traitement d'entretien pour prévenir les rechutes de la méningite à cryptocoques chez les enfants présentant un risque élevé de récidive. | Dose : 6 mg/kg une fois par jour | En fonction de la sévérité de la maladie. |
- Prophylaxie des infections à Candida chez les patients immunodéprimés | Dose : 3 à 12 mg/kg une fois par jour | En fonction de l'importance et de la durée de la neutropénie induite (voir posologie chez l'adulte). |
Adolescents (âgés de 12 à 17 ans) :
Le prescripteur déterminera la posologie la plus appropriée (adultes ou enfants) en fonction du poids et du développement pubère de l'adolescent. Les données cliniques indiquent que les enfants ont une clairance du fluconazole plus élevée que celle observée chez les adultes. Une dose de 100, 200 et 400 mg chez l'adulte correspond à une dose de 3, 6 et 12 mg/kg chez l'enfant pour obtenir une exposition systémique comparable.
Nouveau-nés à terme (âgés de 0 à 27 jours) :
Les nouveau-nés éliminent lentement le fluconazole. On dispose de peu de données pharmacocinétiques à l'appui de cette posologie chez les nouveau-nés à terme .
Groupe d'âge | Posologie | Recommandations |
Nouveau-né à terme (0 à 14 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 72 heures | Une posologie maximale de 12 mg/kg toutes les 72 heures ne doit pas être dépassée. |
Nouveau-né à terme (15 à 27 jours) | La même dose en mg/kg que pour les nourrissons, jeunes enfants et enfants doit être administrée toutes les 48 heures | Une posologie maximale de 12 mg/kg toutes les 48 heures ne doit pas être dépassée. |
Mode d'administration
FLUCONAZOLE peut être administré soit par voie orale soit par perfusion intraveineuse, la voie d'administration dépendant de l'état clinique du patient. Lors du passage de la voie intraveineuse à la voie orale, ou vice versa, il n'est pas nécessaire de modifier la dose quotidienne.
La perfusion intraveineuse doit être administrée à une vitesse ne dépassant pas 10 ml/minute. FLUCONAZOLE est formulé dans une solution pour perfusion de chlorure de sodium à 9 mg/ml (0,9%), chaque dose de 200 mg (flacon de 100 ml) contenant 15 mmol de Na+ et 15 mmol de Cl-. Etant donné que FLUCONAZOLE se présente sous forme d'une solution diluée dans du chlorure de sodium, il faudra veiller à la vitesse d'administration de la solution chez les patients nécessitant une restriction sodique ou hydrique.
Indications
Indications - FLUCONAZOLE - usage systémique
Adultes
Traitement des mycoses causées par Candida, Cryptococci et autres levures sensibles, en particulier:
Candidoses systémiques (incluant les candidoses disséminées et profondes et les péritonites).
Candidoses muqueuses graves (incluant les candidoses oropharyngées, candidoses sophagiennes et candidoses broncho-pulmonaires non invasives), lorsque le traitement par voie orale est impossible.
Méningites à cryptocoques.
Prophylaxie contre les infections profondes à Candida (particulièrement Candida albicans) chez les patients exposés à une neutropénie due à une greffe de moelle osseuse.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antifongiques. Avant de débuter le traitement, des prélèvements doivent être effectués pour une analyse microbiologique et l'adéquation du traitement doit être confirmée par la suite .
Chez certains patients avec des méningites à cryptocoques graves, la réponse mycologique au cours du traitement au fluconazole peut être plus lente comparée à d'autres traitements .
Enfants et adolescents
Traitement des mycoses causées par Candida et autres levures sensibles, en particulier:
Candidoses systémiques (incluant les candidoses disséminées profondes et péritonites)
Candidoses muqueuses graves (incluant les candidoses oropharyngées, candidoses sophagiennes et candidoses broncho-pulmonaires non invasives), lorsque le traitement par voie orale est impossible.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antifongiques. Avant de débuter le traitement, des prélèvements doivent être effectués pour une analyse microbiologique et l'adéquation du traitement doit être confirmée par la suite .
Contre-indications
Hypersensibilité à la substance active (fluconazole) ou à l'un des excipients ou aux autres dérivés azolés.
Le fluconazole ne doit pas être administré en même temps que certains médicaments qui prolongent l'intervalle QT et qui sont métabolisés par le CYP3A4, notamment le cisapride, l'astémizole, la terfénadine, le pimozide et la quinidine.
Effets indésirables
Effets indésirables - FLUCONAZOLE - usage systémique
Au cours des études cliniques, près de 10 % des patients ont présenté des effets indésirables. Environ 1 % ont interrompu le traitement en raison de ces effets indésirables.
Les effets indésirables suivants liés au traitement ont été rapportés chez 4048 patients recevant du fluconazole pendant 7 jours ou plus au cours des essais cliniques:
| Classe Organe | Fréquent ≥ 1/100, < 1/10 | Peu fréquent ≥ 1/1000, < 1/100 | Rare ≥ 1/10000, < 1/1000 | Très rare < 1/10000, non connu (ne peut être évalué à partir des données disponibles) |
Système sanguin et lymphatique | | Anémie | | |
Système immunitaire | | | Anaphylaxie | |
Psychiatrique | | Insomnie Somnolence | | |
Système nerveux central et périphérique | Mal de tête | Convulsion Etourdissements Paresthésie Tremblements Vertiges | | |
Système nerveux végétatif | | Sécheresse buccale Augmentation de la sudation | | |
Sens particuliers | | Perversion du goût | | |
Gastro-intestinal | Nausées Vomissements Douleurs abdominales Diarrhées | Anorexie Constipation Dyspepsie Flatulence | | |
Hépatobiliaire | Augmentation cliniquement significative de l'AST, ALT et de la phosphatase alcaline | Cholestase Lésion hépatocellulaire Ictère Augmentation cliniquement significative de la bilirubine totale | Nécrose hépatique | |
Peau et phanères | Rash cutané | Prurit | Maladies cutanées exfoliatrices (syndrome de Stevens- Johnson) | |
Musculo- squelettique Général | | Myalgie Fatigue Malaise Asthénie Fièvre | | |
Les effets indésirables ont été plus souvent rapportés chez les patients infectés par le VIH (21 %) que chez les patients non infectés par ce virus (13 %). Cependant, les mécanismes des effets indésirables chez les séropositifs VIH sont semblables à ceux des patients non infectés par le VIH.
De plus, les effets indésirables suivants ont été observés dans des situations où la relation de cause à effet est incertaine (c'est à dire essais ouverts, lors d'expérience post commercialisation):
| Classe Organe | Effets indésirables |
Infections et infestations | Infection due à des microorganismes résistants |
Affections hématologiques et du système lymphatique | Leucopénie y compris neutropénie et agranulocytose, thrombocytopénie, éosinophilie |
Affections du système immunitaire | Angio-dème, dème de la face, démangeaisons, urticaire |
Troubles du métabolisme et de la nutrition | Hypercholestérolémie, hypertriglycéridémie, hypokaliémie |
Affections du système nerveux | Crises convulsives |
Affections cardiaques | |
Affections hépatobiliaires | Dysfonctionnement hépatique, hépatite |
Affections de la peau et du tissu sous-cutané | Alopécie, syndrome de Lyell (nécrolyse épidermique toxique) |
Surdosage
En cas de surdosage, des soins adaptés et un traitement symptomatique devront être fournis.
Le fluconazole est principalement excrété dans les urines, par conséquent une diurèse forcée peut augmenter le taux d'élimination. Une hémodialyse de trois heures réduit les concentrations plasmatiques d'environ 50 %.
Grossesse/Allaitement
Grossesse
Les données recueillies sur plusieurs centaines de femmes enceintes qui ont reçu des doses standard (inférieures à 200 mg/jour) de fluconazole, en dose unique ou doses répétées durant le premier trimestre, ne révèlent aucun effet indésirable sur le ftus.
Des anomalies congénitales multiples ont été constatées (notamment brachycéphalies, dysplasies auriculaires, fontanelles antérieures géantes, fémurs arqués et synostoses radio-humérales) chez des enfants dont la mère avait reçu pendant au moins 3 mois de fortes doses (de 400 à 800 mg/jour) de fluconazole dans le traitement de coccidioïdomycoses. La relation entre ces effets et le fluconazole n'est pas prouvée.
Le fluconazole administré à des doses standard et à court terme ne doit pas être administré pendant la grossesse sauf si cela s'avère clairement nécessaire. Le fluconazole à fortes doses et/ou dans un schéma posologique prolongé ne doit pas être administré pendant la grossesse sauf si cela s'avère clairement nécessaire (en cas d'infections mettant en jeu le pronostic vital). En raison des effets tératogènes potentiels, les femmes en âge de procréer doivent prendre un contraceptif efficace pendant le traitement.
Allaitement
Le fluconazole passe dans le lait à des concentrations inférieures à celles du plasma. L'allaitement peut être poursuivi après l'administration unique d'une dose standard de 200 mg ou moins de fluconazole. L'allaitement n'est pas conseillé après une administration répétée ou à fortes doses de fluconazole.
Interactions avec d'autres médicaments
Des interactions ont été constatées consécutivement à la prise de fluconazole avec:
Associations contre-indiquées
+ Astémizole (substrat du CYP3A4):
+ Cisapride (substrat du CYP3A4):
Des cas de défaillance cardiaque incluant des torsades de pointes ont été décrits chez les patients prenant à la fois du fluconazole et du cisapride. Un traitement combinant le fluconazole au cisapride est contre-indiqué.
+ Terfénadine (associée à une dose de fluconazole de 400 mg ou plus; substrat du CYP3A4):
En raison de l'apparition de dysrythmies cardiaques sévères dues à un allongement de l'intervalle QTC chez les patients traités à la fois par des produits azolés et de la terfénadine, des études d'interaction ont été conduites. Une étude a montré que l'administration de 200 mg de fluconazole par jour n'a pas conduit pas à l'allongement de l'intervalle QTC. Une autre étude avec 400 mg et 800 mg de fluconazole par jour a montré qu'une dose quotidienne supérieure ou égale à 400 mg de fluconazole augmente de façon significative la concentration plasmatique de la terfénadine, si les deux médicaments sont pris de manière concomitante. L'association de la terfénadine et du fluconazole à des doses supérieures ou égales à 400 mg est contre-indiquée. Pour des doses de fluconazole inférieures à 400 mg, le patient devra être étroitement surveillé.
Médicaments pouvant affecter le métabolisme et l'excrétion du fluconazole
+ Hydrochlorothiazide:
Dans une étude d'interaction pharmacocinétique chez des volontaires sains recevant du fluconazole ainsi que des doses multiples d'hydrochlorothiazide de manière concomitante, on constate une augmentation de 40 % des concentrations plasmatiques du fluconazole. Un effet de cette ampleur ne doit pas avoir pour conséquence un changement de la posologie du fluconazole chez les patients traités également par des diurétiques, même si le médecin doit garder en mémoire cet état de fait.
+ Rifampicine (inducteur du CYP 450):
La prise concomitante de fluconazole et de rifampicine résulte en une baisse de l'ASC de 25 % et une réduction de la demi-vie du fluconazole de 20 %. Une modification (augmentation) de la posologie du fluconazole doit être considérée lorsque l'utilisation concomitante avec la rifampicine est envisagée.
Effets possibles du fluconazole sur le métabolisme d'autres médicaments
Le fluconazole est un puissant inhibiteur de l'isoenzyme 2C9 du cytochrome P450 (CYP) et un inhibiteur modéré du CYP3A4. Outre les interactions observées/documentées citées ci-dessous, il existe un risque d'augmentation des concentrations plasmatiques d'autres médicaments métabolisés par le CYP2C9 ou le CYP3A4 (par exemple les alcaloïdes du seigle et la quinidine) en cas d'administration concomitante avec Fluconazole. Par conséquent, ces associations doivent toujours être administrées avec prudence, et le patient doit être étroitement surveillé. L'effet inhibiteur du fluconazole sur les enzymes peut persister 4 à 5 jours après la fin du traitement par Fluconazole, en raison de la longue demi-vie du fluconazole.
+ Alfentanil (substrat du CYP3A4):
L'administration concomitante par voie intraveineuse de 400 mg de fluconazole et d'alfentanil à raison de 20 mcg/kg chez les volontaires sains a augmenté l'ASC10 de l'alfentanil d'approximativement 2 fois sa valeur et a diminué la clairance de 55 %, probablement par inhibition du CYP3A4. Ces associations peuvent exiger un ajustement de la dose.
+ Amitriptyline:
De nombreux cas ont décrit l'augmentation des concentrations de l'amitriptyline et des signes de toxicité tricyclique lorsque l'amitriptyline est administrée en association avec le fluconazole. La coadministration avec la nortriptyline, métabolite actif de l'amitriptyline, a conduit à une augmentation des concentrations en nortriptyline. En raison du risque de toxicité de l'amitriptyline, les concentrations de celle-ci doivent être surveillées et des ajustements de posologie doivent être effectués si nécessaire.
+ Anti-coagulants (substrat du CYP2C9):
Il a été montré que la prise concomitante de fluconazole en cours de traitement par la warfarine prolonge le temps de prothrombine jusqu'à deux fois sa valeur initiale. Cela est probablement dû à l'inhibition du métabolisme de la warfarine par le CYP2C9. Le temps de prothrombine doit être étroitement surveillé chez les patients traités par des dérivés de la coumarine.
+ Médicaments anti-rétroviraux (substrat du CYP3A4):
Des cas d'augmentation des concentrations sériques suivant l'administration simultanée de fluconazole avec des agents anti-rétroviraux tels que la névirapine ont été rapportés.
+ Benzodiazépines (substrat du CYP3A4):
La prise concomitante de 400 mg de fluconazole et de 7,5 mg de midazolam par voie orale a augmenté l'ASC et la demi-vie du midazolam respectivement de 3,7 fois et 2,2 fois leur valeur. Le fluconazole à une dose de 100 mg administrée avec 0,25 mg de triazolam par voie orale, entraîne une augmentation de l'ASC du triazolam et de sa demi-vie respectivement de 2,5 et 1,8 fois leur valeur. Des effets potentialisés et prolongés du triazolam ont été observés lors du traitement concomitant avec du fluconazole. Si le traitement concomitant par une benzodiazépine est nécessaire chez les patients traités par fluconazole, il faut envisager une baisse de la dose de benzodiazépine et le patient doit être étroitement surveillé.
+ Antagonistes de la pompe à calcium (substrat du CYP3A4):
Certaines dihydropyridines, antagonistes de la pompe à calcium incluant la nifédipine, l'isradipine, la nicardipine, l'amlodipine et la félodipine, sont métabolisées par le CYP3A4. Des cas d'dèmes périphériques étendus, vertige, hypotension, maux de tête, rougeur du visage et/ou de concentrations sériques élevées des antagonistes du calcium ont été constatés après l'administration simultanée de l'itraconazole avec de la félodipine, de l'isradipine ou de la nifédipine. Par conséquent, une interaction similaire avec le fluconazole est possible.
+ Carbamazépine (substrat du CYP3A4):
Des cas d'augmentation des concentrations sériques en carbamazépine à la suite de l'administration simultanée de fluconazole et de la carbamazépine ont été rapportés.
+ Célécoxib (substrat du CYP2C9):
Dans une étude clinique, 200 mg de fluconazole par jour administré avec 200 mg de célécoxib ont augmenté la Cmax et l'ASC du célécoxib de 68 % et 134 % respectivement. L'interaction est attribuée vraisemblablement à l'inhibition du métabolisme du cytochrome P450 2C9 du célécoxib. Une réduction de 50 % de la posologie du célécoxib est recommandée chez les patients prenant également du fluconazole.
+ Ciclosporine (substrat du CYP3A4):
Des interactions cliniquement significatives avec la ciclosporine ont eu lieu avec des doses de fluconazole supérieures ou égales à 200 mg. Au cours d'une étude pharmacocinétique chez des patients transplantés rénaux recevant à la fois 200 mg de fluconazole par jour ainsi que 2,7 mg/kg/jour de ciclosporine, il a été démontré une augmentation de l'ASC de la ciclosporine de 1,8 fois sa valeur et une diminution de 55 % de sa clairance. Il est recommandé de surveiller les concentrations plasmatiques de ciclosporine chez les patients prenant du fluconazole.
+ Didanosine:
L'administration simultanée de didanosine et de fluconazole ne semble pas affecter les paramètres pharmacocinétiques et l'action de la didanosine. Il peut s'avérer utile de reprogrammer l'administration de fluconazole afin qu'elle précède celle de la didanosine.
+ Halofantrine (substrat du CYP3A4):
Les médicaments qui inhibent le CYP3A4 conduisent à une inhibition du métabolisme de l'halofantrine et peuvent entraîner un allongement de l'intervalle QT. L'utilisation concomitante du fluconazole et de l'halofantrine n'est pas recommandée.
+ Inhibiteurs de l'HMG-CoA réductase (substrat du CYP2C9 ou du CYP3A4):
Le risque de myopathie est augmenté en cas de prise simultanée de fluconazole avec des inhibiteurs de l'HMG-CoA reductase métabolisés par le CYP3A4, notamment l'atorvastatine ou la simvastatine, ou par le CYP2C9, telle que la fluvastatine. Dans le cas de la fluvastatine, une hausse individuelle jusqu'à 200 % de l'aire sous la courbe (ASC) peut découler de l'interaction entre la fluvastatine et le fluconazole. Il faut être particulièrement vigilant si le fluconazole doit être administré avec des inhibiteurs de l'HMG-CoA reductase. L'association peut exiger une diminution de la dose de l'inhibiteur de l'HMG-CoA réductase. Les signes et les symptômes de myopathie ou de rhabdomyolyse et les concentrations de créatine kinase (CK) doivent être surveillés chez les patients. Le traitement à l'HMG-CoA reductase doit être interrompu si les concentrations en CK montrent une hausse marquée ou en cas de diagnostic ou de suspicion de myopathie ou de rhabdomyolyse.
+ Losartan (substrat du CYP2C9):
Le fluconazole inhibe la conversion du losartan en ses métabolites actifs (E-3174), responsable pour une large partie de l'inhibition du récepteur de l'angiotensine II qui a lieu au cours d'un traitement avec le losartan. La prise concomitante de fluconazole peut causer une hausse des concentrations de losartan et une baisse des concentrations de ses métabolites actifs. Un contrôle continu de l'hypertension chez les patients recevant cette combinaison est recommandé.
+ Méthadone (substrat du CYP3A4):
Des cas d'effet majoré de la méthadone suite à l'administration simultanée du fluconazole et de la méthadone ont été rapportés. Une étude pharmacocinétique a montré une augmentation moyenne de 35 % de l'ASC de la méthadone.
+ Contraceptifs oraux:
Deux études pharmacocinétiques ont été menées avec des contraceptifs oraux combinés et des doses répétées de fluconazole. Aucun effet particulier au niveau hormonal n'a été constaté avec l'administration de 50 mg de fluconazole. La prise journalière de 200 mg de fluconazole a entraîné une hausse de l'ASC de l'éthinylestradiol et du lévonorgestrel de 40 % et 24 % respectivement. Par conséquent, il est improbable que des doses multiples du fluconazole exercent une influence sur l'effet des contraceptifs oraux combinés.
+ Phénytoïne (substrat du CYP2C9):
L'administration concomitante de fluconazole et de phénytoïne peut augmenter les concentrations de phénytoïne à un degré cliniquement significatif. La prise simultanée de 200 mg de fluconazole et de 250 mg de phénytoïne par voie intraveineuse augmente l'ASC de la phénytoïne de 75 % et la Cmin de 128 %. Si le traitement associant les deux substances est nécessaire, la concentration de la phénytoïne doit faire l'objet d'un contrôle et la dose doit être ajustée afin de maintenir les concentrations thérapeutiques et d'éviter les concentrations toxiques.
+ Prédnisone (substrat du CYP3A4):
Un transplanté hépatique recevant de la prédnisone a développé une maladie d'Addison à la suite de l'arrêt d'un traitement au fluconazole d'une durée de 3 mois. Le sevrage de fluconazole a probablement entraîné une augmentation de l'activité du CYP3A4, ayant pour conséquence une augmentation du catabolisme de la prédnisone. Les patients recevant un traitement au long cours associant le fluconazole à la prédnisone, devraient être étroitement surveillés avec recherche des signes d'insuffisance surrénale lorsque le fluconazole est interrompu.
+ Rifabutine (substrat du CYP3A4):
Des cas ont rapporté qu'il existe une interaction entre le fluconazole et la rifabutine, entraînant une augmentation des concentrations plasmatiques de la rifabutine. Des cas d'uvéites ont été constatés chez des patients traités avec cette association. Les patients recevant simultanément du fluconazole et de la rifabutine doivent faire l'objet d'une étroite surveillance.
+ Dérivés de la sulfonylurée (substrat du CYP2C9):
Il a été prouvé que le fluconazole prolonge la demi-vie plasmatique des sulfonylurées orales administrées simultanément (chlorpropamide, glibenclamide, glipizide et tolbutamide) chez des volontaires sains. Le fluconazole et les dérivés de la sulfonylurée orale peuvent être administrés aux patients diabétiques, la possibilité de faire une hypoglycémie doit cependant être considérée. Les taux de glucose dans le sang doivent être étroitement surveillés.
+ Tacrolimus et sirolimus (substrats du CYP3A4):
La prise concomitante de Fluconazole (100 mg ou 200 mg) et de tacrolimus à raison de 0,15 mg/kg 2 fois par jour a entraîné une hausse de la Cmin de 1,4 et 3,1 fois pour des doses respectives de 100 et 200 mg. Des cas de néphrotoxicité ont été rapportés chez des patients traités simultanément avec du fluconazole et du tacrolimus. Bien qu'aucune étude d'interaction n'ait été menée pour le fluconazole et le sirolimus, une interaction similaire à celle obtenue avec le tacrolimus peut être attendue. Les patients recevant simultanément du tacrolimus ou du sirolimus avec du fluconazole doivent être étroitement surveillés par des dosages des concentrations plasmatiques en tacrolimus/sirolimus et la recherche de toxicité.
+ Théophylline:
L'administration de 200 mg de fluconazole pendant 14 jours a entraîné une baisse de 18 % de la clairance plasmatique moyenne de la théophylline. Les patients recevant de fortes doses de théophylline, ou présentant par ailleurs un risque accru de toxicité à la théophylline, doivent être étroitement surveillés et un ajustement de la posologie de la théophylline peut être nécessaire.
+ Trimétrexate:
Le fluconazole peut inhiber le métabolisme du trimétrexate, causant une augmentation des concentrations plasmatiques du trimétrexate. Si l'association est inévitable, les concentrations sériques et la toxicité du trimétrexate doivent être étroitement contrôlées.
+ Bases de xanthine, autres médicaments antiépileptiques et isoniazide:
Des tests de suivi doivent être effectués en cas d'administration simultanée avec des bases de xanthine, d'autres médicaments antiépileptiques ou de l'isoniazide.
+ Zidovudine:
Des études d'interaction ont révélé que lors de la prise concomitante de zidovudine avec une dose quotidienne de 200 mg ou 400 mg de fluconazole, les valeurs de l'ASC de la zidovudine peuvent augmenter de 20 % à 70 %, probablement en raison de l'inhibition de la conversion en glucuronide. Il faut contrôler l'apparition des effets indésirables en relation à la zidovudine chez les patients recevant cette association.
Autres interactions avec des médicaments
+ Amphotéricine B:
Des études in vitro et in vivo effectuées sur des animaux ont révélé un effet antagoniste entre l'amphotéricine B et les dérivés azolés. Le mécanisme d'action des imidazoles est d'inhiber la synthèse de l'ergostérol dans les membranes cellulaires fongiques. L'amphotéricine B agit en se liant aux stérols des membranes cellulaires et en modifiant leur perméabilité membranaire. L'effet clinique de cet antagonisme est encore inconnu et un effet similaire peut se produire avec le complexe cholestéryl sulfate de l'amphotéricine B.
+ Médicaments provoquant un allongement de l'intervalle QT:
Des observations indiquent que le fluconazole peut provoquer un allongement de l'intervalle QT, et donc une arythmie cardiaque grave. Les patients traités simultanément avec du fluconazole et d'autres médicaments prolongeant l'intervalle QT doivent être surveillés attentivement car un effet additif ne peut être exclu.
Des études d'interactions ont montré qu'aucun changement clinique significatif de l'absorption de fluconazole ne survient après une radiothérapie du corps entier exigée par une greffe de la moelle osseuse.

 Français
Français Русский
Русский