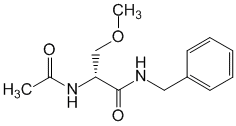
Pharmacodynamique
Le lacosamide a induit dans une large variété de modèles animaux une protection contre les crises partielles et les crises généralisées primaires, et a retardé le développement d'une épilepsie par stimulation électrique (kindling).
Dans les essais non cliniques, le lacosamide associé au lévétiracétam, à la carbamazépine, à la phénytoïne, au valproate, à la lamotrigine, au topiramate ou à la gabapentine présente des effets anticonvulsivants synergiques ou additifs.
Pharmacocinétique
Pharmacocinétique - LACOSAMIDE - voie orale
Absorption
Le lacosamide est rapidement et complètement absorbé après administration orale. La biodisponibilité orale des comprimés de lacosamide est approximativement de 100 %. Après administration orale, la concentration plasmatique du lacosamide sous forme inchangée augmente rapidement et la Cmax est atteinte environ 0,5 à 4 heures après l'administration. Les aliments n'affectent pas le taux et l'importance de l'absorption.
Distribution
Le volume de distribution est approximativement égal à 0,6 L/kg. Le lacosamide montre une liaison aux protéines plasmatiques inférieure à 15 %.
Biotransformation
95 % de la dose sont excrétés dans l'urine sous forme de substance active et sous forme de métabolites. Le métabolisme du lacosamide n'a pas été complètement identifié.
Les principaux composés excrétés dans l'urine sont le lacosamide sous forme inchangée (approximativement 40 % de la dose) et son métabolite O-desméthyl (moins de 30 %).
Une fraction polaire considérée comme étant des dérivés de la sérine représente approximativement 20 % dans l'urine, mais a été détectée seulement en faible quantité (entre 0 et 2 %) dans le plasma de quelques sujets. De faibles quantités (0,5 à 2 %) de métabolites additionnels sont retrouvées dans l'urine.
Les données in vitro montrent que les CYP2C9, CYP2C19 et CYP3A4 peuvent catalyser la formation du métabolite O-desméthyl-lacosamide mais le principal isoenzyme y contribuant n'a pas été confirmé in vivo. Aucune différence cliniquement significative de l'exposition au lacosamide n'a été observée en comparant sa pharmacocinétique chez les métaboliseurs importants (MI ou métaboliseurs rapides ayant un CYP2C19 fonctionnel) et les métaboliseurs faibles (MF ou métaboliseurs lents manquant de CYP2C19 fonctionnel). De plus, un essai d'interactions avec l'oméprazole (inhibiteur du CYP2C19) n'a pas montré de modification cliniquement significative des concentrations plasmatiques de lacosamide indiquant que l'importance de cette voie est mineure. La concentration plasmatique en O-desméthyl-lacosamide est approximativement de 15 % de la concentration plasmatique de lacosamide. Ce métabolite principal n'a pas d'activité pharmacologique connue.
Élimination
Le lacosamide est principalement éliminé de la circulation par excrétion rénale et biotransformation. Après administration orale et intraveineuse de lacosamide radiomarqué, environ 95 % de la radioactivité administrée est retrouvée dans l'urine, et moins de 0,5 % dans les fèces. La demi-vie d'élimination de la substance active sous forme inchangée est approximativement de 13 heures. La pharmacocinétique est proportionnelle à la dose et constante dans le temps, avec de faibles variations intra et interindividuelles. Après une administration deux fois par jour, les concentrations plasmatiques à l'état d'équilibre sont obtenues au bout de 3 jours. La concentration plasmatique augmente avec un facteur d'accumulation approximativement de 2.
Les concentrations à l'état d'équilibre après une dose de charge unique de 200 mg sont comparables aux concentrations obtenues après administration orale de 100 mg deux fois par jour.
Propriétés pharmacocinétiques dans certaines populations de patients
Sexe
Les études cliniques indiquent que le sexe n'a pas d'influence cliniquement significative sur les concentrations plasmatiques du lacosamide.
Insuffisance rénale
L'aire sous la courbe (ASC) du lacosamide est augmentée d'environ 30 % chez les patients présentant une insuffisance rénale légère à modérée, et de 60 % chez les insuffisants rénaux sévères et les patients ayant une affection rénale au stade terminal nécessitant une hémodialyse par rapport à des sujets sains, tandis que la Cmax n'est pas modifiée.
Le lacosamide est efficacement éliminé du plasma par hémodialyse. Après une hémodialyse de quatre heures, l'ASC du lacosamide est réduite d'approximativement 50 %. Par conséquent, une dose supplémentaire est recommandée après une hémodialyse . L'exposition au métabolite O-desméthyl est augmentée de plusieurs fois chez les patients insuffisants rénaux modérés et sévères. En l'absence d'hémodialyse chez les patients ayant une affection rénale au stade terminal, les taux sont augmentés et continuent à augmenter pendant l'échantillonnage de 24 heures. On ne sait pas si une augmentation de l'exposition au métabolite chez les sujets au stade terminal pourrait augmenter les effets indésirables mais aucune activité pharmacologique de ce métabolite n'a été identifiée.
Insuffisance hépatique
Les sujets atteints d'insuffisance hépatique modérée (score Child-Pugh B) ont montré des concentrations plasmatiques de lacosamide supérieures (environ 50 % plus élevées que l'aire sous la courbe normale). Cette exposition plus importante était en partie due à une fonction rénale réduite chez les sujets étudiés. La diminution de la clairance non rénale chez les patients de l'essai était responsable de l'augmentation de 20 % de l'ASC du lacosamide. Les propriétés pharmacocinétiques du lacosamide n'ont pas été évaluées chez les sujets présentant une insuffisance hépatique sévère .
Sujet âgé (plus de 65 ans)
Dans une étude chez des hommes et des femmes âgés, incluant 4 patients de plus 75 ans, l'ASC était augmentée d'environ 30 et 50 % respectivement, comparativement aux hommes jeunes. Ceci est en partie lié à un poids corporel plus faible. La différence normalisée de poids corporel est de 26 et 23 % respectivement. Une augmentation de la variabilité en termes d'exposition a également été observée. La clairance rénale du lacosamide n'était que légèrement diminuée chez le sujet âgé dans cette étude.
Une réduction systématique de la posologie n'est pas considérée comme nécessaire, sauf en cas d'insuffisance rénale .
Indications
Indications - LACOSAMIDE - usage systémique
LACOSAMIDE est indiqué en monothérapie et en association dans le traitement des crises partielles avec ou sans généralisation secondaire chez l'adulte et l'adolescent (16-18 ans) présentant une épilepsie.
Contre-indications
Bloc auriculo-ventriculaire connu (AV) du 2ème ou du 3ème degré.
Effets indésirables
Effets indésirables - LACOSAMIDE - usage systémique
Résumé du profil de tolérance
En se basant sur l'analyse poolée des études cliniques contrôlées versus placebo, en association, ayant porté sur 1 308 patients atteints d'épilepsie partielle, un total de 61,9 % des patients du groupe lacosamide et 35,2 % des patients du groupe placebo ont rapporté au moins un effet indésirable. Les effets indésirables les plus fréquemment notifiés (≥ 10 %) pendant le traitement par le lacosamide ont été les suivants : sensations vertigineuses, céphalées, nausées et diplopie. Ils ont été généralement d'intensité légère à modérée. Certains d'entre eux ont été dépendants de la dose et ont pu être soulagés en réduisant la posologie. L'incidence et la sévérité des réactions indésirables affectant le système nerveux central (SNC) et le tractus gastro-intestinal ont généralement diminué avec le temps.
Dans toutes ces études contrôlées, le taux d'arrêts de traitement dus à des effets indésirables a été de 12,2 % pour les patients du groupe lacosamide et de 1,6 % chez les patients du groupe placebo. L'effet indésirable ayant entraîné le plus fréquemment une interruption du traitement a été la survenue de sensations vertigineuses.
L'incidence des effets indésirables affectant le SNC, comme les sensations vertigineuses, pourrait être supérieure après administration d'une dose de charge.
Sur la base de l'analyse des données d'un essai clinique de non-infériorité en monothérapie comparant le lacosamide à la carbamazépine à libération prolongée (LP), les effets indésirables le plus fréquemment rapportés (≥ 10 %) avec le lacosamide ont été des céphalées et des sensations vertigineuses. Le taux d'arrêt de traitement en raison d'effets indésirables a été de 10,6 % pour les patients traités par lacosamide et 15,6 % pour les patients traités par carbamazépine LP.
Tableau des effets indésirables
Le tableau ci-dessous montre les fréquences des effets indésirables qui ont été rapportés lors des études cliniques et depuis la commercialisation. Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classe de systèmes d'organes | Très fréquent | Fréquent | Peu fréquent | Fréquence indéterminée |
Affections hématologiques et du système lymphatique | | | | Agranulocytose(1) |
Affections du système immunitaire | | | Hypersensibilité médicamenteuse(1) | Syndrome d'hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)(1,2) |
Affections psychiatriques | | Dépression Confusion Insomnie(1) | Agressivité(1) Agitation(1) Humeur euphorique(1) Troubles psychotiques(1) Tentative de suicide(1) Idées suicidaires(1) Hallucination(1) | |
Affections du système nerveux | Sensations vertigineuses Céphalées | Troubles de l'équilibre Troubles de la coordination Troubles de la mémoire Troubles cognitifs Somnolence Tremblements Nystagmus Hypoesthésie Dysarthrie Troubles de l'attention Paresthésie | Syncope(2) | |
Affections oculaires | Diplopie | Vision trouble | | |
Affections de l'oreille et du labyrinthe | | Vertiges Acouphènes | | |
Affections cardiaques | | | Bloc auriculo-ventriculaire((1,2) Bradycardie(1,2) Fibrillation auriculaire(1,2) Flutter auriculaire(1,2) | |
Affections gastro-intestinales | Nausées | Vomissements Constipation Flatulences Dyspepsie Sécheresse buccale Diarrhée | | |
Affections hépatobiliaires | | | Anomalies des tests de la fonction hépatique(2) Augmentation des enzymes hépatiques (> 2x LSN (limite supérieure de la normale))(1) | |
Affections de la peau et du tissu sous-cutané | | Prurit Eruptions cutanées(1) | Angidème(1) Urticaire(1) | Syndrome de Stevens-Johnson(1) Nécrolyse épidermique toxique(1) |
Affections musculo-squelettiques et systémiques | | Spasmes musculaires | | |
Troubles généraux et anomalies au site d'administration | | Troubles de la marche Asthénie Fatigue Irritabilité Sensation d'ébriété | | |
Lésions, intoxications et complications liées aux procédures | | Chute Lacérations cutanées Contusion | | |
(1) Effets indésirables rapportés depuis la commercialisation.
(2) Voir Description d'effets indésirables sélectionnés.
Description d'effets indésirables sélectionnés
L'utilisation du lacosamide est associée à une augmentation dose-dépendante de l'intervalle PR. Des effets indésirables associés à un allongement de l'espace PR (bloc auriculo-ventriculaire, syncope, bradycardie) peuvent survenir. Lors des études cliniques en association chez les patients épileptiques, le taux d'incidence des blocs AV du 1er degré rapportés est peu fréquent : respectivement 0,7 % ; 0 % ; 0,5 % et 0 % pour le lacosamide 200 mg, 400 mg, 600 mg ou le placebo. Aucun bloc AV du deuxième degré ou plus élevé n'a été observé lors de ces études. Cependant, des cas de blocs AV du deuxième et du troisième degré associés au traitement par le lacosamide ont été rapportés depuis la commercialisation. Dans l'essai clinique en monothérapie comparant le lacosamide à la carbamazépine LP, l'amplitude de l'augmentation de l'intervalle PR a été comparable entre le lacosamide et la carbamazépine.
Le taux d'incidence des syncopes rapporté dans des essais cliniques poolés en association est peu fréquent et n'a montré aucune différence entre les patients épileptiques traités par le lacosamide (n = 944) (0,1 %) et les patients épileptiques recevant le placebo (n = 364) (0,3 %). Dans l'essai clinique en monothérapie comparant lacosamide à carbamazépine LP, des syncopes ont été rapportées chez 7/444 (1,6 %) patients traités par lacosamide et chez 1/442 (0,2 %) patients traités par carbamazépine LP.
Aucun cas de fibrillation ou de flutter auriculaires n'a été rapporté lors des études cliniques à court terme ; cependant, des cas ont été rapportés lors des études cliniques en ouvert et depuis la commercialisation.
Anomalies biologiques
Des anomalies des tests de la fonction hépatique ont été observées lors des études contrôlées avec le lacosamide chez les patients adultes présentant des crises partielles et qui prenaient 1 à 3 médicaments antiépileptiques associés. Une augmentation des ALAT ≥ 3 x LSN est apparue chez 0,7 % (7/935) des patients traités par lacosamide et 0 % (0/356) des patients sous placebo.
Réactions d'hypersensibilité avec atteinte multiviscérale
Des réactions d'hypersensibilité avec atteinte multiviscérale (connues également sous le nom de syndrome d'hypersensibilité médicamenteuse (DRESS)) ont été rapportées chez des patients traités par certains médicaments antiépileptiques. Ces réactions sont d'expression variable mais avec un tableau typique associant fièvre et éruption cutanée, et peuvent impliquer différents organes. En cas de suspicion d'une réaction d'hypersensibilité avec atteinte multiviscérale, le lacosamide doit être arrêté.
Population pédiatrique
Il est attendu que la fréquence, le type et la sévérité des effets indésirables chez l'adolescent de 16 à 18 ans soient les mêmes que chez l'adulte. La sécurité du lacosamide chez les enfants âgés de moins de 16 ans n'a pas encore été établie. Aucune donnée n'est disponible.
Sujet âgé
Dans l'étude en monothérapie comparant le lacosamide à la carbamazépine LP, les types d'effets indésirables liés au lacosamide chez les sujets âgés (≥ 65 ans) semblent être similaires à ceux observés chez les patients de moins de 65 ans. Cependant, une incidence plus élevée (différence ≥ 5 %) de chute, diarrhée et tremblement a été rapportée chez les patients âgés par rapport aux patients adultes plus jeunes. L'effet indésirable cardiaque le plus fréquemment rapporté chez les personnes âgées par rapport à la population plus jeune a été un bloc AV du premier degré. Cela a été rapporté avec le lacosamide chez 4,8 % (3/62) des patients âgés versus 1,6 % (6/382) des patients adultes plus jeunes. Le taux d'arrêt de traitement en raison d'effets indésirables observés avec le lacosamide a été de 21,0 % (13/62) chez les patients âgés versus 9,2 % (35/382) chez les patients adultes plus jeunes. Ces différences entre les patients âgés et les patients plus jeunes étaient similaires à celles observées dans le groupe du comparateur actif.
Surdosage
Symptômes
Les symptômes observés après un surdosage accidentel ou intentionnel en lacosamide sont principalement associés au SNC et au système gastro-intestinal.
La nature des effets indésirables observés chez les patients exposés à des doses supérieures à 400 mg et jusqu'à 800 mg n'est pas cliniquement différente de celle observée chez les patients recevant les doses recommandées de lacosamide.
Les réactions rapportées après une prise de plus de 800 mg sont sensations vertigineuses, nausées, vomissements, convulsions (crises généralisées tonico-cloniques, état de mal épileptique). Des troubles de la conduction cardiaque, choc et coma ont également été observés. Des issues fatales ont été rapportées chez des patients ayant pris une dose unique de plusieurs grammes de lacosamide.
Traitement
Il n'existe aucun antidote spécifique en cas de surdosage par le lacosamide. Le traitement du surdosage par le lacosamide doit comprendre des mesures générales de soutien, et le cas échéant, une hémodialyse .
Grossesse/Allaitement
Grossesse
Risque lié à l'épilepsie et aux antiépileptiques en général
Pour tous les médicaments antiépileptiques, il a été montré que la prévalence des malformations chez les enfants de femmes épileptiques traitées était deux à trois fois supérieure au taux d'environ 3 % dans la population générale. Dans la population traitée, une augmentation des malformations a été notée en cas de polythérapie ; cependant, il n'a pas été déterminé quel était le rôle respectif du traitement et/ou de la maladie.
En outre, un traitement antiépileptique efficace ne doit pas être interrompu, dans la mesure où l'aggravation de la maladie serait préjudiciable pour la mère comme pour le ftus.
Risque lié au lacosamide
Il n'existe pas de données suffisantes sur l'utilisation du lacosamide chez la femme enceinte. Des études chez l'animal n'ont pas indiqué d'effets tératogènes chez le rat ou le lapin, mais une embryotoxicité a été observée chez le rat et le lapin à des doses toxiques pour la mère . Le risque potentiel dans l'espèce humaine est inconnu.
Le lacosamide ne doit pas être utilisé au cours de la grossesse, sauf en cas de nécessité manifeste (c'est-à-dire lorsque le bénéfice pour la mère prévaut clairement sur le risque potentiel pour le ftus). Si une femme prévoit une grossesse, l'utilisation de ce produit doit être soigneusement réévaluée.
Allaitement
Le passage du lacosamide dans le lait maternel n'est pas établi. Les études chez l'animal ont montré l'existence d'une excrétion de lacosamide dans le lait maternel. Par précaution, l'allaitement devra être interrompu durant le traitement par lacosamide.
Fertilité
Aucun effet indésirable n'a été observé sur la fertilité ou la reproduction des rats mâles ou femelles aux doses produisant une exposition plasmatique (ASC) jusqu'à environ 2 fois celle observée chez l'Homme à la dose maximale recommandée.
Interactions avec d'autres médicaments
Le lacosamide doit être administré avec précaution chez les patients traités par des médicaments connus pour être associés à un allongement de l'espace PR (carbamazépine, lamotrigine, eslicarbazépine, prégabaline) et chez ceux traités par des antiarythmiques de classe I. Toutefois, les analyses de sous-groupes au cours des essais cliniques n'ont pas identifié d'augmentation de l'importance de l'allongement de l'espace PR chez les patients en cas d'administration concomitante de carbamazépine ou de lamotrigine.
Données in vitro
Les données suggèrent généralement que le lacosamide entraîne assez peu d'interactions médicamenteuses. Les études in vitro montrent que les enzymes CYP1A2, 2B6 et 2C9 ne sont pas induits et que CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2D6 et 2E1 ne sont pas inhibés par le lacosamide aux concentrations plasmatiques observées dans les essais cliniques. Une étude in vitro montre que le lacosamide n'est pas transporté par la glycoprotéine P dans l'intestin. Les données in vitro montrent que les CYP2C9, CYP2C19 et CYP3A4 peuvent catalyser la formation du métabolite O-desméthyl.
Données in vivo
Le lacosamide n'a pas d'effet inhibiteur ou inducteur des CYP2C19 et 3A4 cliniquement pertinent. Le lacosamide ne modifie pas l'ASC du midazolam (métabolisé par le CYP3A4, lacosamide 200 mg 2 fois par jour) mais la Cmax du midazolam a été légèrement augmentée (30 %). Le lacosamide ne modifie pas la pharmacocinétique de l'oméprazole (métabolisé par les CYP2C19 et 3A4, lacosamide 300 mg 2 fois par jour).
L'oméprazole (40 mg/jour), inhibiteur du CYP2C19, n'a pas entraîné d'augmentation cliniquement significative de l'exposition au lacosamide. Par conséquent, il est peu probable que les inhibiteurs modérés du CYP2C19 modifient de façon cliniquement pertinente l'exposition systémique au lacosamide.
La prudence est recommandée en cas de traitement concomitant avec de puissants inhibiteurs du CYP2C9 (par ex., fluconazole) et du CYP3A4 (par ex., itraconazole, kétoconazole, ritonavir, clarithromycine), qui peuvent provoquer une augmentation de l'exposition systémique au lacosamide. De telles interactions n'ont pas été établies in vivo mais sont possibles sur la base des données in vitro.
Des inducteurs enzymatiques puissants comme la rifampicine ou le millepertuis (Hypericum perforatum) peuvent réduire modérément l'exposition systémique du lacosamide. Par conséquent, la mise en uvre ou l'interruption d'un traitement par ces inducteurs enzymatiques doit être effectuée avec précaution.
Antiépileptiques
Dans les essais d'interactions médicamenteuses, le lacosamide n'a pas affecté de manière significative les concentrations plasmatiques de la carbamazépine et de l'acide valproïque. Les concentrations plasmatiques en lacosamide n'ont pas été affectées par la carbamazépine et l'acide valproïque. L'analyse pharmacocinétique de population montre qu'un traitement concomitant avec d'autres antiépileptiques connus pour être des inducteurs enzymatiques (carbamazépine, phénytoïne et phénobarbital à différentes doses) diminue l'exposition systémique globale du lacosamide de 25 %.
Contraceptifs oraux
Dans une étude d'interactions, il n'a été observé aucune interaction cliniquement significative entre le lacosamide et les contraceptifs oraux, éthinylstradiol et lévonorgestrel. Les concentrations de progestérone n'ont pas été affectées lorsque les médicaments ont été co-administrés.
Autres
Les études d'interactions médicamenteuses ont montré que le lacosamide n'a pas d'effet sur la pharmacocinétique de la digoxine. Il n'y a pas d'interaction cliniquement significative entre le lacosamide et la metformine.
La co-administration de warfarine avec le lacosamide n'a pas entraîné de modification cliniquement significative de la pharmacocinétique et de la pharmacodynamie de la warfarine.
Bien qu'aucune donnée pharmacocinétique sur l'interaction entre le lacosamide et l'alcool ne soit disponible, un effet pharmacodynamique ne peut être exclu.
Le lacosamide montre une faible liaison aux protéines, inférieure à 15 %. Par conséquent, les interactions cliniquement significatives avec d'autres substances actives par compétition au niveau des sites de liaison aux protéines sont considérées comme peu probables.

 Français
Français Русский
Русский