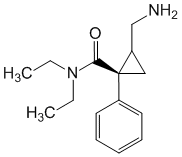
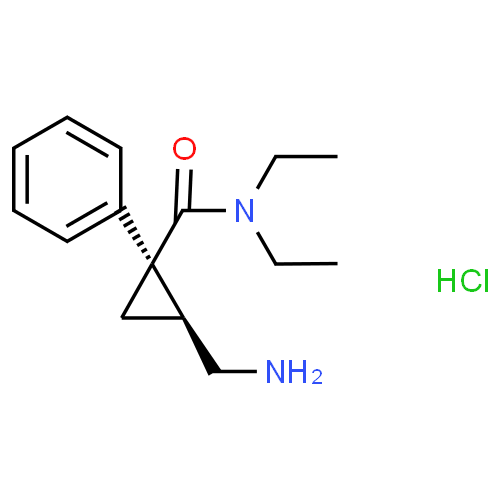
Pharmacodynamique
Le milnacipran est un inhibiteur double de la recapture de la sérotonine (5-HT) et de la noradrénaline (NA).
Contrairement à la plupart des antidépresseurs tricycliques, le milnacipran n'a pas d'affinité pour les récepteurs a1-adrénergiques ou histaminergiques H1.
Des études expérimentales suggèrent l'absence d'affinité du milnacipran pour les récepteurs cholinergiques (muscariniques).
Par ailleurs, le milnacipran n'a également pas d'affinité pour les récepteurs dopaminergiques D1 et D2, benzodiazépiniques et opioïdes.
Chez l'homme,
à la dose thérapeutique, les concentrations plasmatiques observées sont constamment situées à un niveau correspondant à une inhibition de 50 à 90% de la noradrénaline et de la sérotonine ;
les effets pharmacologiques observés sur les systèmes digestifs et urogénitaux semblent liés à l'inhibition de la recapture de la noradrénaline susceptible d'exercer un antagonisme d'effet vis-à-vis de l'acétylcholine (effet anticholinergique indirect) ;
le milnacipran n'induit aucune modification cliniquement significative de la repolarisation ou de la conduction cardiaque ;
il ne modifie pas les tests cognitifs et a peu d'effet sédatif ;
les troubles du sommeil sont améliorés chez les patients déprimés traités par le milnacipran. Les temps de latence de l'endormissement sont diminués ainsi que le nombre de réveils nocturnes et les temps de latence d'apparition du sommeil paradoxal sont augmentés. La durée totale du sommeil est augmentée.
L'efficacité du milnacipran a été comparée à celle des IRS et des tricycliques et s'est avérée être inférieure à celle de la clomipramine.
Pharmacocinétique
Pharmacocinétique - MILNACIPRAN - voie orale
Absorption
Le milnacipran est bien absorbé après administration orale. La biodisponibilité est de l'ordre de 85%. Elle n'est pas modifiée par l'alimentation.
Le pic de concentration plasmatique (Cmax) est atteint environ 2 heures (Tmax) après administration. Il est de l'ordre de 120 ng/ml après prise unique de 50 mg. Les concentrations augmentent proportionnellement à la dose jusqu'à 200 mg par prise.
Après prises répétées, l'état d'équilibre est atteint en 2 à 3 jours avec une augmentation des concentrations de l'ordre de 70% à 100% par rapport à la prise unique (Cmax = 216 ng/ml). La variabilité interindividuelle est faible.
Distribution
Le taux de liaison aux protéines plasmatiques est faible (13%) et non saturable.
Le volume de distribution du milnacipran est d'environ 5 l/kg avec une clairance totale de l'ordre de 40 l/h.
Les clairances rénales et non rénales sont équivalentes.
Biotransformation
Le métabolisme du milnacipran se limite essentiellement à une glucuroconjugaison.
De très petites quantités de métabolites actifs, sans effet clinique, ont été retrouvées.
Élimination
La demi-vie d'élimination plasmatique est d'environ 8 heures.
L'élimination se fait essentiellement par voie urinaire (90% de la dose administrée) avec une sécrétion tubulaire du produit inchangé.
Après prises répétées, le milnacipran est totalement éliminé deux à trois jours après l'arrêt du traitement.
Populations à risque
Insuffisants hépatiques
L'insuffisance hépatique n'entraîne pas de modification significative des paramètres pharmacocinétiques du milnacipran.
Insuffisants rénaux
En cas d'insuffisance rénale, l'élimination du milnacipran est ralentie, proportionnellement au degré d'altération de la fonction rénale .
Patients âgés de plus de 65 ans
Les paramètres pharmacocinétiques du milnacipran ne sont pas modifiés significativement chez le sujet âgé. Il convient cependant de tenir compte de l'altération physiologique de la fonction rénale .
Dosage
Dosage - MILNACIPRAN - voie orale
Gélule
Posologie et mode d'administration
La dose recommandée est de 100 mg par jour, répartie en deux prises de 50 mg, 1 gélule le matin et 1 gélule le soir à prendre de préférence au cours des repas.
Dans ce cas, utiliser des gélules à 50 mg.
Chez le sujet âgé : une adaptation posologique n'est pas nécessaire tant que la fonction rénale est normale .
Chez l'insuffisant rénal : une adaptation posologique est nécessaire. Il est recommandé de réduire la posologie à 50 ou 25 mg en fonction du degré d'altération de la fonction rénale . Dans ce cas, utiliser des gélules à 25 mg.
L'adaptation posologique suivante est recommandée :
Clairance créatinine (Clcr) (ml/mn) | Posologie / 24 h |
Clcr ³ 60 | 50 mg x 2 |
60 > Clcr ³ 30 | 25 mg x 2 |
30 > Clcr ³ 10 | 25 mg |
Durée de traitement
Le traitement par antidépresseur est symptomatique.
Comme lors de tout traitement antidépresseur, l'efficacité du milnacipran apparaît seulement après un certain délai pouvant varier de 1 à 3 semaines.
Le traitement d'un épisode est de plusieurs mois (habituellement de l'ordre de 6 mois) afin de prévenir les risques de rechute de l'épisode dépressif.
Le traitement par le milnacipran doit être interrompu progressivement.
Traitements psychotropes associés
L'adjonction d'un traitement sédatif ou anxiolytique peut être utile en début de traitement, afin de couvrir la survenue ou l'aggravation de manifestations d'angoisse.
Toutefois, les anxiolytiques ne protègent pas forcément de la levée de l'inhibition.
Indications
Indications - MILNACIPRAN - usage systémique
Traitement des épisodes dépressifs majeurs (c'est-à-dire caractérisés) de l'adulte.
Contre-indications
Ce médicament NE DOIT JAMAIS ETRE UTILISE dans les cas suivants :
association avec les IMAO irréversibles ,
allaitement.
hypertension non contrôlée, maladie coronarienne sévère ou instable, car les augmentations de la tension artérielle ou de la fréquence cardiaque peuvent aggraver ces pathologies sous-jacentes.
Effets indésirables
Effets indésirables - MILNACIPRAN - usage systémique
Les effets indésirables observés durant le traitement par le milnacipran sont surtout notés durant la première voire les deux premières semaines du traitement et s'estompent par la suite, parallèlement à l'amélioration de l'épisode dépressif.
Ils sont généralement bénins et ne conduisent que rarement à l'arrêt du traitement.
Les événements indésirables les plus communément rapportés en monothérapie ou lors d'associations avec d'autres psychotropes lors des essais cliniques et survenant moins souvent chez les patients traités par placebo sont: vertiges, hypersudation, anxiété, bouffées de chaleur et dysurie.
Les événements indésirables moins communément rapportés sont: nausées, vomissements, sécheresse buccale, constipation, tremblements, palpitations, agitation, céphalée, urticaire, éruptions cutanées (rash) parfois maculo-papuleuses, érythémateuses, prurit.
Il convient de noter que chez les patients présentant des antécédents cardiovasculaires ou recevant simultanément un traitement à visée cardiaque, l'incidence des effets indésirables de nature cardiovasculaire peut être augmentée (par exemple, hypertension, hypotension, hypotension orthostatique, tachycardie et palpitations).
Rarement, peuvent être observés:
un syndrome sérotoninergique en association avec d'autres produits ;
une rétention urinaire ;
des convulsions, en particulier chez les patients ayant des antécédents d'épilepsie ;
des douleurs testiculaires, troubles de l'éjaculation;
une élévation modérée des transaminases, réversible à l'arrêt du traitement. Des cas d'hépatites cytolytiques ont également été rapportés avec le milnacipran depuis sa commercialisation.
Exceptionnellement peuvent être observés:
une hyponatrémie ;
des ecchymoses et autres saignements cutanéo-muqueux .
Des cas d'idées et de comportements suicidaires ont été rapportés durant le traitement par milnacipran ou peu après son arrêt .
Par ailleurs, certains effets indésirables sont liés à la nature même de la maladie dépressive:
levée de l'inhibition psychomotrice, avec risque suicidaire;
inversion de l'humeur avec apparition d'épisodes maniaques;
réactivation d'un délire chez les sujets psychotiques;
manifestations paroxystiques d'angoisse (pour les antidépresseurs psychostimulants).
Surdosage
Quelques cas de surdosage ont été observés sous milnacipran.
Aux doses élevées, l'effet émétisant peut limiter considérablement le risque de surdosage.
A la dose de 200 mg ont été observées très fréquemment (> 10%) : nausées, hypersudation et constipation.
Aux doses de 800 mg à 1 g et en monothérapie, les principaux symptômes observés sont : vomissements, troubles respiratoires (apnées) et tachycardie.
A dose massive (1,9 g à 2,8 g), en association avec d'autres médicaments (notamment des benzodiazépines) s'y ajoutent les signes suivants : somnolence, hypercapnie et troubles de la conscience.
Traitement en cas de surdosage
Il n'existe pas d'antidote spécifique du milnacipran.
Le traitement est symptomatique, avec lavage gastrique et administration de charbon activé dès que possible après ingestion orale.
La surveillance médicale devra être maintenue pendant au moins 24 heures.
Grossesse/Allaitement
Grossesse
Les données concernant l'utilisation du milnacipran chez la femme enceinte sont insuffisantes. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction .
Un risque a été rapporté pour le nouveau-né en cas d'exposition aux inhibiteurs de la recapture de la sérotonine au cours de la grossesse et peut correspondre, soit à un syndrome de sevrage, soit à une toxicité de la sérotonine : tachypnée, difficulté à s'alimenter, tremblements, hypertonie ou hypotonie, troubles du sommeil, hyperexcitabilité ou plus rarement pleurs persistants. Tous ces signes apparaissent dans les premiers jours de vie et sont généralement de courte durée et non sévères.
En conséquence, l'utilisation du milnacipran n'est pas recommandée pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception.
Allaitement
En raison d'un faible passage du milnacipran dans le lait maternel, l'allaitement est contre-indiqué.
Fertilité
Le milnacipran affecte la fertilité chez le rat et induit une létalité embryonnaire sans marge de sécurité
Aucune donnée concernant l'effet du milnacipran sur la fertilité n'est disponible chez l'homme.
Interactions avec d'autres médicaments
Les études d'interactions ont été réalisées uniquement chez l'adulte.
Syndrome sérotoninergique
Comme avec d'autres agents sérotoninergiques, le développement d'un syndrome sérotoninergique pouvant engager le pronostic vital, peut survenir sous traitement par milnacipran, en particulier en cas d'utilisation concomitante avec d'autres substances susceptibles d'affecter le système de neurotransmission sérotoninergique (notamment les IMAO irréversibles (iproniazide), les IMAO-A sélectifs réversibles (linézolide, moclobémide, le bleu de méthylène), le millepertuis [Hypericum perforatum], la pethidine, le tramadol, la plupart des antidépresseurs
Les symptômes du syndrome sérotoninergique peuvent être d'ordre :
digestifs (diarrhée)
neuropsychiques (agitation, confusion, hypomanie)
moteurs (tremblements, rigidité, myoclonies, hyperreflexie et ataxie)
végétatifs (variations tensionnelles, tachycardie, frissons, hyperthermie, éventuellement coma)
Associations contre-indiquées
IMAO irréversible (iproniazide)
Risque d'apparition d'un syndrome sérotoninergique*
Respecter un délai de deux semaines entre l'arrêt de l'IMAO et le début du traitement par le milnacipran, et d'au moins une semaine entre l'arrêt du milnacipran et le début du traitement par l'IMAO.
Associations déconseillées
Sympathomimétiques alpha et bêta (voies IM et IV)
Dans le cas d'une action systémique par voie parentérale.
Hypertension paroxystique avec possibilité de troubles du rythme (inhibition de l'entrée du sympathomimétique dans la fibre sympathique).
IMAO sélectif A (linézolide moclobémide, bleu de méthylène)
Risque d'apparition d'un syndrome sérotoninergique* (cf. supra).
Si l'association ne peut être évitée, surveillance clinique très étroite. Débuter l'association aux posologies minimales recommandées.
Associations faisant l'objet de précautions d'emploi
Adrénaline (voie bucco-dentaire ou sous-cutanée)
Troubles du rythme ventriculaire graves par augmentation de l'excitabilité cardiaque
Limiter l'apport, par exemple moins de 0,1 mg d'adrénaline en 10 minutes ou 0,3 mg en une heure, chez l'adulte.
Anticoagulants oraux, les médicaments qui ont un effet sur la fonction plaquettaire, c'est à dire les anti-inflammatoires non stéroïdiens et l'aspirine ou d'autres médicaments qui peuvent augmenter le risque de saignement.

 Français
Français Русский
Русский