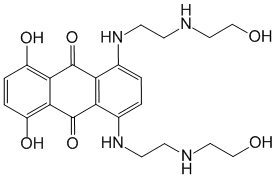
Pharmacocinétique - MITOXANTRONE - usage parentéral
Absorption
Chez les patients, la pharmacocinétique de la mitoxantrone après administration d'une dose unique peut être caractérisée par un modèle à trois compartiments. Chez les patients ayant reçu 15 à 90 mg/m², on observe une relation linéaire entre la dose et l'aire sous la courbe de concentration (ASC). L'accumulation plasmatique de la substance active n'était pas apparente lorsque la mitoxantrone était administrée soit quotidiennement pendant cinq jours, soit en dose unique toutes les trois semaines.
Distribution
La distribution vers les tissus est importante : le volume de distribution à l'état d'équilibre dépasse 1 000 l/m². Les concentrations plasmatiques diminuent rapidement au cours des deux premières heures et lentement par la suite. Le taux de liaison de la mitoxantrone aux protéines plasmatiques est de 78%. La fraction liée est indépendante de la concentration et n'est pas influencée par la présence de phénytoïne, de doxorubicine, de méthotrexate, de prednisone, de prednisolone, d'héparine ou d'aspirine. La mitoxantrone ne traverse pas la barrière hémato-encéphalique. La distribution dans les testicules est relativement faible.
Biotransformation et élimination
Les voies de métabolisation de la mitoxantrone n'ont pas été établies. La mitoxantrone est excrétée lentement dans l'urine et les fèces, soit sous une forme inchangée, soit sous la forme de métabolites inactifs. Dans les études réalisées chez l'homme, seuls 10% et 18% de la dose ont été récupérés dans l'urine et les fèces respectivement, soit sous la forme de substance active, soit sous la forme de métabolite, pendant les 5 jours qui ont suivi l'administration du médicament. Pour 65% du matériel récupéré dans l'urine, il s'agissait de substance active sous une forme inchangée. Les 35% restants étaient composés de dérivés de l'acide monocarboxylique et dicarboxylique et de leurs glycuroconjugués.
Plusieurs des valeurs de demi-vie rapportées pour la phase d'élimination se situent entre 10 et 40 heures, mais beaucoup d'autres auteurs ont rapporté des valeurs bien plus longues comprises entre 7 et 12 jours. Les différences dans les estimations peuvent être dues à la disponibilité des données tard après la dose, la pondération des données et la sensibilité de l'analyse.
Populations particulières
La clairance de la mitoxantrone peut être réduite par l'insuffisance hépatique.
Il ne semble pas y avoir de différences pertinentes entre la pharmacocinétique de la mitoxantrone chez les patients âgés et les jeunes adultes. On ignore quel est l'effet du sexe, de la race et de l'insuffisance rénale sur la pharmacocinétique de la mitoxantrone.
La pharmacocinétique de la mitoxantrone dans la population pédiatrique est inconnue.
La mitoxantrone doit être administrée sous la supervision d'un médecin expérimenté dans l'utilisation d'agents chimiothérapeutiques cytotoxiques.
Cancer du sein métastatique, lymphome non hodgkinien
En monothérapie
La dose initiale recommandée de mitoxantrone, utilisée en monothérapie, est de 14 mg/m² de surface corporelle, administrée en une dose intraveineuse unique pouvant être renouvelée à 21 jours d'intervalle. Une dose initiale plus faible (12 mg/m² ou moins) est recommandée chez les patients présentant une réserve médullaire inadéquate, par ex. en raison d'une chimiothérapie antérieure ou d'un mauvais état général.
La modification de la posologie et le calendrier des administrations ultérieures seront déterminés par l'évaluation clinique qui se basera sur le degré et la durée de la myélosuppression. Pour les cycles de traitement ultérieurs, la dose précédente peut généralement être répétée si le nombre de globules blancs et de plaquettes est revenu à la normale après 21 jours.
Le tableau suivant propose quelques recommandations quant à l'ajustement posologique, dans le traitement du cancer du sein métastatique et du lymphome non hodgkinien, en fonction du nadir hématologique (qui est généralement atteint 10 jours environ après l'administration).
Nadir des globules blancs et des plaquettes | Délai de récupération | Administration suivante |
Si le nadir des globules blancs est > 1.500 µl et le nadir des plaquettes est > 50.000 µl | La récupération est ≤ 21 jours | Répéter la dose antérieure |
Si le nadir des globules blancs est > 1.500 µl et le nadir des plaquettes est > 50.000 µl | La récupération est > 21 jours | Attendre jusqu'à la récupération ; ensuite répéter la dose antérieure |
Si le nadir des globules blancs est < 1.500 µl ou le nadir des plaquettes est < 50.000 µl | Quelle que soit la durée | Diminuer de 2 mg/m2 par rapport à la dose antérieure, après la récupération. |
Si le nadir des globules blancs est < 1.000 µl ou le nadir des plaquettes est < 25.000 µl | Quelle que soit la durée | Diminuer de 4 mg/m2 par rapport à la dose antérieure, après la récupération. |
Traitement combiné
La mitoxantrone a été administrée dans le cadre d'un traitement combiné. Dans le cancer du sein métastatique, les associations de la mitoxantrone et d'autres agents cytotoxiques, dont le cyclophosphamide et le 5 fluorouracil ou le méthotrexate et la mitomycine C, se sont révélées efficaces.
La mitoxantrone a également été utilisée dans de nombreuses associations dans le traitement du lymphome non hodgkinien ; toutefois, les données sont actuellement limitées et des schémas spécifiques ne peuvent être recommandés.
Dans les traitements combinés, la mitoxantrone s'est révélée efficace aux doses initiales comprises entre 7 à 8, 8 à 10 et 10 à 12 mg/m², selon l'association et la fréquence utilisée.
En règle générale, lorsque la mitoxantrone est utilisée dans une chimiothérapie combinée avec un autre agent myélosuppresseur, la dose initiale de mitoxantrone doit être réduite de 2 à 4 mg/m² par rapport aux doses recommandées en monothérapie ; le dosage ultérieur, comme détaillé dans le tableau ci-dessus, sera en fonction du degré et de la durée de la myélosuppression.
Leucémie myéloïde aiguë
En monothérapie dans le cadre d'une récidive
La dose initiale recommandée de mitoxantrone, pour l'induction d'une rémission, est de 12 mg/m² de surface corporelle, administrée en une dose intraveineuse unique par jour pendant cinq jours consécutifs (au total, 60 mg/m²). Dans les études cliniques portant sur une dose de 12 mg/m² par jour pendant 5 jours, les patients qui ont obtenu une rémission complète ont présenté ce résultat après le premier cycle d'induction.
Traitement combiné
Pour une induction, la dose recommandée est de 12 mg/m² de mitoxantrone par jour aux Jours 1 à 3, administrée en perfusion intraveineuse, et de 100 mg/m² de cytarabine pendant 7 jours administrée en perfusion intraveineuse continue de 24 heures aux Jours 1 à 7.
La plupart des rémissions complètes surviendront après le premier cycle de traitement d'induction. Dans le cas d'une réponse anti-leucémique incomplète, un second cycle d'induction peut être proposé en administrant la mitoxantrone pendant 2 jours et la cytarabine pendant 5 jours selon les mêmes niveaux de doses journaliers. Si l'on observe une toxicité non hématologique sévère ou menaçant le pronostic vital durant le premier cycle d'induction, le second cycle d'induction ne doit pas être proposé tant que la toxicité n'est pas résolue.
Le traitement de consolidation utilisé dans deux vastes études multicentriques randomisées consistait en l'administration d'une perfusion de 12 mg/m² de mitoxantrone par jour aux Jours 1 à 2 et de 100 mg/m² de cytarabine pendant 5 jours en perfusion intraveineuse continue de 24 heures aux Jours 1 à 5. Le premier cycle de consolidation était administré environ 6 semaines après le dernier cycle d'induction et le second cycle, généralement 4 semaines après le premier.
Un cycle unique de mitoxantrone 6 mg/m² en bolus intraveineux (IV), d'étoposide 80 mg/m² par voie intraveineuse sur une période de 1 heure, et de cytarabine (Ara-C) 1 g/m² par voie intraveineuse pendant une période de 6 heures par jour pendant 6 jours (MEC) a révélé une activité anti-leucémique salvatrice dans le cas d'une LMC réfractaire.
Traitement de la crise blastique dans la leucémie myéloïde (chronique)
En dose unique dans le cadre d'une récidive
La dose initiale recommandée, dans le cadre d'une récidive, est de 10 à 12 mg/m² de surface corporelle, administrée en une dose intraveineuse unique par jour pendant 5 jours consécutifs (au total, 50 à 60 mg/m²).
Cancer avancé de la prostate résistant à la castration
Selon les données issues de deux études comparant la mitoxantrone plus corticostéroïdes et les corticostéroïdes seuls, la dose recommandée de mitoxantrone est de 12 à 14 mg/m² administrée en perfusion intraveineuse courte tous les 21 jours, en association avec de faibles doses de corticostéroïdes par voie orale.
Les patients cancéreux ayant reçu des doses cumulées de 140 mg/m², seules ou en association à d'autres agents chimiothérapeutiques, présentaient un risque cumulé d'insuffisance cardiaque congestive clinique de 2,6%. Pour cette raison, les patients doivent être surveillés afin de déceler tout signe de toxicité cardiaque et ils seront interrogés sur les symptômes d'insuffisance cardiaque avant l'instauration du traitement et pendant celui-ci.
Sclérose en plaques
Le traitement par mitoxantrone doit être administré sous la supervision d'un médecin expérimenté dans l'utilisation d'agents chimiothérapeutiques cytotoxiques dans le traitement de la sclérose en plaques.
Ce traitement ne doit être utilisé qu'après évaluation des risques et des bénéfices, en particulier les risques hématologiques et cardiaques .
Le traitement ne doit pas être instauré chez des patients qui ont déjà été traités par mitoxantrone.
La dose recommandée de mitoxantrone est généralement de 12 mg/m² de surface corporelle, administrée en perfusion intraveineuse de courte durée (environ 5 à 15 minutes) pouvant être répétée tous les 1 à 3 mois. La dose cumulée maximale pendant toute la vie du patient, ne doit pas dépasser 72 mg/m² .
Si la mitoxantrone est administrée de manière répétée, les ajustements posologiques doivent être guidés par l'importance et la durée de la myélosuppression.
Numération sanguine différentielle dans les 21 jours qui suivent la perfusion de mitoxantrone
Signes et symptômes d'une infection et numération sanguine différentielle de grade 3 selon l'OMS : dose suivante, 10 mg/m²
Signes et symptômes d'une infection et numération sanguine différentielle de grade 4 selon l'OMS : dose suivante, 8 mg/m²
Numération sanguine différentielle 7 jours avant la perfusion de mitoxantrone
Signes et symptômes d'une infection et numération sanguine différentielle de grade 1 selon l'OMS : dose suivante, 9 mg/m²
Signes et symptômes d'une infection et numération sanguine différentielle de grade 2 selon l'OMS : dose suivante, 6 mg/m²
Signes et symptômes d'une infection et numération sanguine différentielle de grade 3 à 4 selon l'OMS : arrêter le traitement
En cas de toxicité non hématologique de grade 2 à 3 selon l'OMS, la dose suivante doit être ajustée à 10 mg/m² ; en cas de toxicité hématologique de grade 4, le traitement doit être arrêté.
Populations particulières
Patients âgés
En règle générale, pour un patient âgé, le choix de dose initiale se portera sur les doses les plus faibles et tiendra compte de la fréquence accrue de la diminution de la fonction hépatique, rénale ou cardiaque ainsi que des maladies concomitantes ou du traitement par d'autres médicaments.
Insuffisance rénale
La sécurité de la mitoxantrone chez les patients insuffisants rénaux n'est pas établie. La mitoxantrone doit être utilisée avec prudence.
Insuffisance hépatique
La sécurité de la mitoxantrone chez les patients insuffisants hépatique n'est pas établie. Pour les patients souffrant d'insuffisance hépatique, un ajustement de la dose peut être nécessaire étant donné que la clairance de la mitoxantrone est réduite par l'insuffisance hépatique. Les données sont insuffisantes pour permettre de formuler des recommandations en matière d'ajustement de la dose. Les analyses de laboratoire ne permettent pas de prévoir la clairance de la substance active et des ajustements de la dose .
Population pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques n'ont pas été établies. Il n'existe pas d'utilisation justifiée de la mitoxantrone dans la population pédiatrique.
Mode d'administration
La solution à diluer de MITOXANTRONE doit être administré uniquement par perfusion intraveineuse.
La solution à diluer de MITOXANTRONE doit être injecté lentement dans une perfusion intraveineuse continue de solution saline isotonique ou une solution de glucose à 5% sur une période d'au minimum 3 à 5 minutes. La tubulure doit être insérée de préférence dans une grosse veine. Il convient d'éviter, si possible, les veines au-dessus des articulations ou dans les membres dont le drainage veineux ou lymphatique est compromis.
La solution à diluer de MITOXANTRONE peut également être administré en perfusion courte (15 à 30 minutes) diluée dans 50 à 100 ml de solution saline isotonique ou une solution de glucose à 5%.
La solution à diluer de MITOXANTRONE ne doit pas être administré par voie sous-cutanée, intramusculaire ou intra-artérielle. Des lésions tissulaires locales sévères peuvent se produire si une extravasation se produit pendant l'administration. Le médicament ne doit pas non plus être administré par injection intrathécale.
Si des signes ou symptômes d'extravasation sont apparus, notamment une brûlure, une douleur, un prurit, un érythème, un gonflement, une coloration bleue anormale ou une ulcération, l'administration doit être immédiatement interrompue .
Indications - MITOXANTRONE - usage systémique
La mitoxantrone est indiquée dans le traitement du cancer du sein métastatique.
La mitoxantrone est indiquée dans le traitement du lymphome non hodgkinien.
La mitoxantrone est indiquée dans le traitement de la leucémie myéloïde aiguë (LMA) chez l'adulte.
La mitoxantrone, en traitement combiné, est indiquée dans le traitement d'induction de la rémission de la crise blastique dans la leucémie myéloïde chronique.
La mitoxantrone est indiquée en association à des corticostéroïdes pour le traitement palliatif (par ex., soulagement de la douleur) lié au cancer avancé de la prostate résistant à la castration.
La mitoxantrone est indiquée dans le traitement des patients atteints de sclérose en plaques récurrente hautement active associée à une invalidité évoluant rapidement lorsqu'aucune alternative thérapeutique n'existe .
Effets indésirables - MITOXANTRONE - usage systémique
Résumé du profil de sécurité
Les effets indésirables les plus graves rapportés avec la mitoxantrone sont la toxicité myocardique et la myélosuppression. Les effets indésirables les plus fréquents associés à la mitoxantrone (observés chez plus de 1 patient sur 10) sont l'anémie, la leucopénie, la neutropénie, les infections, l'aménorrhée, l'alopécie, les nausées et les vomissements.
Tableau des effets indésirables
Le tableau ci-dessous reprend les données de sécurité issues des études cliniques et les déclarations spontanées dans les indications oncologiques et les études cliniques, les études de sécurité après la commercialisation et les déclarations spontanées de patients traités pour une sclérose en plaques. Les fréquences sont établies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à< 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Fréquence | Oncologie | Sclérose en plaques |
Infections et infestations |
Très fréquent | Infection (y compris avec issue fatale) | Infection (y compris avec issue fatale) Infection des voies urinaires Infection des voies respiratoires supérieures |
Peu fréquent | Infection des voies urinaires Infection des voies respiratoires supérieures Septicémie Infections opportunistes | Pneumonie Septicémie Infections opportunistes |
Rare | Pneumonie | |
Néoplasmes bénins et malins (y compris kystes et polypes) |
Peu fréquent | Leucémie myéloïde aiguë, syndrome myélodysplasique, leucémie aiguë | Leucémie myéloïde aiguë, syndrome myélodysplasique, leucémie aiguë |
Affections hématologiques et du système lymphatique |
Très fréquent | Anémie Neutropénie Leucopénie | |
Fréquent | Thrombocytopénie Granulocytopénie | Anémie Leucopénie Granulocytopénie Numération anormale des globules blancs |
Peu fréquent | Myélosuppression Insuffisance médullaire Numération anormale des globules blancs | Insuffisance médullaire Myélosuppression Thrombocytopénie Neutropénie |
Affections du système immunitaire |
Peu fréquent | Anaphylaxie/réactions anaphylactoïdes (y compris choc) | Anaphylaxie/réactions anaphylactoïdes (y compris choc) |
Troubles du métabolisme et de la nutrition |
Fréquent | Anorexie | |
Peu fréquent | Variations du poids Syndrome de lyse tumorale* | Anorexie Variations du poids |
* la leucémie lymphoblastique aiguë des types T et B et le lymphome non hodgkidien (LNH) sont les plus fréquemment associés au syndrome de lyse tumorale |
Affections du système nerveux |
Fréquent | Léthargie | Maux de tête |
Peu fréquent | Anxiété Confusion Maux de tête Paresthésie | Anxiété Confusion Paresthésie Léthargie |
Affections oculaires |
Peu fréquent | Coloration anormale de la sclère | Coloration anormale de la sclère |
Affections cardiaques |
Fréquent | Insuffisance cardiaque congestive Infarctus du myocarde (y compris avec issue fatale) | Arythmies Électrocardiogramme anormal Diminution de la fraction d'éjection ventriculaire gauche |
Peu fréquent | Arythmies Bradycardie sinusale Électrocardiogramme anormal Diminution de la fraction d'éjection ventriculaire gauche | Insuffisance cardiaque congestive Cardiomyopathie Bradycardie sinusale Infarctus du myocarde (y compris avec issue fatale) |
Rare | Cardiomyopathie | |
Affections vasculaires |
Peu fréquent | Contusion Hémorragie Hypotension | Contusion Hémorragie Hypotension |
Affections respiratoires, thoraciques et médiastinales |
Fréquent | Dyspnée | |
Peu fréquent | | Dyspnée |
Affections gastro-intestinales |
Très fréquent | Nausées Vomissements | Nausées |
Fréquent | Constipation Diarrhée Stomatite | Constipation Diarrhée Stomatite Vomissements |
Peu fréquent | Douleurs abdominales Hémorragie gastro-intestinale Inflammation des muqueuses Pancréatite | Douleurs abdominales Hémorragie gastro-intestinale Inflammation des muqueuses Pancréatite |
Affections hépatobiliaires |
Fréquent | | Taux élevé d'aspartate aminotransférase |
Peu fréquent | Toxicité hépatique Taux élevé d'aspartate aminotransférase | Toxicité hépatique |
Affections de la peau et du tissu sous-cutané |
Très fréquent | Alopécie | Alopécie |
Peu fréquent | Érythème Troubles de l'ongle Éruption cutanée Coloration anormale de la peau Nécrose des tissus (après extravasation) | Troubles de l'ongle Éruption cutanée Coloration anormale de la peau Nécrose des tissus (après extravasation) |
Affections du rein et des voies urinaires |
Peu fréquent | Taux élevé de créatinine sérique Taux élevé d'azote uréique du sang Néphropathie toxique Coloration anormale de l'urine | Taux élevé de créatinine sérique Taux élevé d'azote uréique du sang Néphropathie toxique Coloration anormale de l'urine |
Affections des organes de reproduction et du sein |
Très fréquent | | Aménorrhée* |
Peu fréquent | Aménorrhée | |
* L'aménorrhée peut être prolongée et concorder avec une ménopause précoce |
Troubles généraux et anomalies au site d'administration |
Fréquent | Asthénie Fatigue Fièvre | |
Peu fréquent | dème Extravasation* Dysgueusie | Asthénie Fatigue dème Fièvre Extravasation* Mort subite** |
* Une extravasation au site de perfusion a été rapportée ; elle est susceptible de provoquer un érythème, un gonflement, des douleurs, une brûlure et/ou une coloration bleue anormale de la peau. L'extravasation peut entraîner une nécrose des tissus et donc la nécessité d'un débridement de la plaie et d'une greffe de peau. Une phlébite a été également rapportée au site de perfusion. ** La relation causale avec l'administration de mitoxantrone est incertaine. |
Description de certains effets indésirables
Une toxicité myocardique, dont la forme la plus sévère est l'insuffisance cardiaque congestive (ICC) potentiellement irréversible et fatale, peut se produire pendant le traitement par mitoxantrone, voire des mois ou des années après la fin du traitement. Ce risque augmente en fonction de la dose cumulée. Dans les études cliniques, les patients cancéreux ayant reçu des doses cumulées de 140 mg/m², seules ou en association à d'autres agents chimiothérapeutiques, présentaient un risque cumulé d'insuffisance cardiaque congestive clinique de 2,6%.
La myélosuppression est un effet indésirable dose-limitant de la mitoxantrone. La myélosuppression peut être plus prononcée et plus longue chez les patients qui ont reçu auparavant une chimiothérapie ou une radiothérapie. Dans une étude clinique menée chez des patients souffrant d'une leucémie aiguë, une myélosuppression importante s'est produite chez tous les patients qui avaient reçu de la mitoxantrone. Parmi les 80 patients inclus, les valeurs médianes pour les plus faibles numérations de globules blancs et de plaquettes étaient de 400/μl (grade 4 selon l'OMS) et 9 500/μl (grade 4 selon l'OMS) respectivement. La toxicité hématologique est difficile à évaluer dans la leucémie aiguë, car les paramètres traditionnels de la myélosuppression, comme les taux de globules blancs et de plaquettes, se confondent par le remplacement de la moelle par des cellules leucémiques.
Patients atteints de sclérose en plaques
Toxicité hématologique
Une neutropénie peut se produire après chaque administration. Il s'agit en général d'une neutropénie transitoire dont le taux le plus faible de leucocytes est mesuré au jour 10 après la perfusion et revenu à la normale au jour 20 environ. Une thrombocytopénie réversible peut également être observée. Les paramètres hématologiques doivent être régulièrement contrôlés .
Des cas de leucémie myéloïde aiguë (LMA) avec issue fatale ont été rapportés .
Toxicité cardiaque
Des cas d'anomalies à l'ECG ont été rapportés. Des cas d'insuffisance cardiaque congestive avec fraction d'éjection ventriculaire gauche (FEVG) < 50% ont également été rapportés .
Population pédiatrique
Le traitement par mitoxantrone n'est pas recommandé dans la population pédiatrique. La sécurité et l'efficacité n'ont pas été établies.
Contraception chez les hommes et chez les femmes
La mitoxantrone est génotoxique et est considérée comme un agent tératogène potentiel pour l'homme. Il doit donc être conseillé aux hommes sous traitement de ne pas concevoir d'enfant et d'utiliser des mesures contraceptives pendant le traitement et pendant au moins 6 mois après la fin de celui-ci. Il doit être conseillé aux femmes en âge de procréer d'éviter de tomber enceintes ; elles doivent présenter un test de grossesse négatif avant chaque administration de dose et utiliser une contraception efficace pendant le traitement ainsi que pendant au moins 4 mois après l'arrêt du traitement.
Grossesse
Il existe des données très limitées sur l'utilisation de la mitoxantrone chez la femme enceinte. La mitoxantrone n'était pas tératogène dans les études chez l'animal aux doses inférieures à l'exposition chez l'homme, mais elle a provoqué des effets toxiques sur la reproduction . La mitoxantrone est considérée comme un agent tératogène potentiel pour l'homme en raison de son mécanisme d'action et des effets sur le développement qui ont été démontrés par des agents similaires. Pour cette raison, l'utilisation de la mitoxantrone dans le traitement de la SEP est contre-indiquée chez la femme enceinte . Utilisée pour d'autres indications, la mitoxantrone ne doit pas être administrée pendant la grossesse, en particulier au cours du premier trimestre de la grossesse. Dans chaque cas, le bénéfice du traitement doit être mis en balance par rapport au risque encouru par le ftus. Si ce médicament est utilisé pendant la grossesse ou si la patiente débute une grossesse pendant un traitement par mitoxantrone, il conviendra d'informer la patiente du risque potentiel pour le ftus et de fournir un conseil génétique.
Allaitement
La mitoxantrone est excrétée dans le lait maternel et a été détectée dans le lait maternel pendant une période allant jusqu'à un mois après la dernière administration. Puisque la mitoxantrone peut provoquer de graves effets indésirables chez le nourrisson, l'allaitement est contre-indiqué et il doit être arrêté avant de démarrer le traitement.
Fertilité
Les femmes traitées par mitoxantrone présentent un risque accru d'aménorrhée passagère ou persistante, c'est pourquoi il est préférable d'envisager la conservation des gamètes avant le traitement. Pour les hommes, il n'existe pas de données disponibles, mais une atrophie tubulaire des testicules et un nombre réduit de spermatozoïdes ont été observés chez l'animal .
L'association de la mitoxantrone avec des substances actives potentiellement cardiotoxiques (par ex., les anthracyclines) augmente le risque de toxicité cardiaque.
Lorsqu'ils sont utilisés avec d'autres agents antinéoplasiques et/ou une radiothérapie, les inhibiteurs de la topoisomérase II, notamment la mitoxantrone, ont été associés à l'apparition d'une leucémie myéloïde aiguë (LMA) ou d'un syndrome myélodysplasique (SMD) .
La mitoxantrone provoque une dépression médullaire comme prolongement de son activité pharmacologique. La myélosuppression peut être augmentée lorsque la mitoxantrone est utilisée en association avec une chimiothérapie par un autre agent myélosuppresseur comme pour le traitement du cancer du sein.
L'association de la mitoxantrone et d'autre immunosuppresseur peut augmenter le risque d'une dépression médullaire excessive et d'un syndrome lymphoprolifératif.
L'immunisation par des vaccins à virus vivants (par ex., le vaccin contre la fièvre jaune) augmente le risque d'infection et d'autres effets indésirables tels que la vaccine nécrotique et la vaccine généralisée, chez les patients dont l'immunité est réduite, comme lors d'un traitement par mitoxantrone. Par conséquent, les vaccins vivants ne doivent pas être administrés pendant le traitement. Il est conseillé d'utiliser les vaccins à virus vivants avec prudence après l'arrêt d'une chimiothérapie et de ne procéder à une vaccination qu'après un délai de 3 mois après la dernière dose de chimiothérapie .
L'association d'antagonistes de la vitamine K et d'agents cytotoxiques peut entraîner une augmentation du risque de saignement. Chez les patients traités par anticoagulants oraux, le temps de prothrombine ou l'INR doit être étroitement surveillé lors de l'ajout et du retrait du traitement par mitoxantrone et il doit être réévalué plus fréquemment pendant un traitement concomitant. Des ajustements de la dose d'anticoagulants peuvent être nécessaires dans le but de maintenir le degré d'anticoagulation souhaité.
In vitro, la mitoxantrone s'est révélée être un substrat pour la protéine de transport BCRP. Les inhibiteurs du transporteur BCRP (par ex., eltrombopag, gefitinib) peuvent entraîner une biodisponibilité accrue. Dans une étude pharmacocinétique menée chez des enfants présentant une leucémie myéloïde aiguë de novo, un traitement concomitant par ciclosporine induit une réduction de 42% de la clairance de la mitoxantrone. Les inducteurs du transporteur BCRP sont susceptibles de réduire l'exposition à la mitoxantrone.
La mitoxantrone et ses métabolites sont excrétés dans la bile et l'urine, mais on ignore si les voies métaboliques ou d'élimination métabolique sont saturables, si elles peuvent être inhibées ou être induites, ou encore si la mitoxantrone et ses métabolites subissent un cycle entéro-hépatique .

 Français
Français Русский
Русский