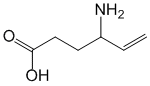
Pharmacodynamique
La
vigabatrine est un antiépileptique dont le mécanisme d'action est clairement défini. Le traitement par la vigabatrine entraîne une augmentation de la concentration du GABA (acide gamma-aminobutyrique), principal neurotransmetteur cérébral inhibiteur. La vigabatrine est un inhibiteur irréversible sélectif de la GABA-transaminase, enzyme responsable du catabolisme du GABA.
Pharmacocinétique
Pharmacocinétique - VIGABATRINE - voie orale
Absorption
La vigabatrine est un produit hydrosoluble, dont l'absorption digestive est rapide et totale.
La prise de nourriture n'influence pas l'absorption de la vigabatrine. Le temps pour atteindre la concentration plasmatique maximale (Tmax) est approximativement 1 heure.
Distribution
Le produit se distribue de manière importante, avec un volume de distribution apparent légèrement supérieur à celui de l'eau corporelle totale. Les concentrations dans le plasma et dans le liquide céphalorachidien sont proportionnelles à la dose administrée dans l'intervalle des posologies recommandées.
Biotransformation
Vigabatrine n'est pas métabolisé de façon significative. Aucun métabolite n'a été identifié dans le plasma.
Élimination
La vigabatrine est éliminée par excrétion rénale avec une demi-vie d'élimination terminale comprise entre 5 et 8 heures. La clairance orale (Cl/F) est approximativement de 7 L/h (i.e. 0,10 L/h/kg). Approximativement 70 % de la dose administrée ont été retrouvés inchangés dans les urines 24 heures après l'administration d'une dose orale unique.
Relations pharmacocinétique/pharmacodynamique
Il n'y a pas de corrélation directe entre la concentration plasmatique et l'efficacité. La durée d'action du produit dépend de la vitesse de re-synthèse de la GABA-transaminase.
Population pédiatrique
Les propriétés pharmacocinétiques de la vigabatrine ont été étudiées dans des groupes de six nouveau-nés (âgés de 15 à 26 jours), six nourrissons (5 à 22 mois) et six enfants (4,6 à 14,2 ans) souffrant d'épilepsie résistante. Après l'administration d'une dose unique de 37-50 mg/kg de vigabatrine en solution orale, le Tmax était approximativement de 2,5 heures chez les nouveau-nés, 5,7 heures chez les nourrissons et 5,5 heures chez les enfants. La moyenne Cl/F de l'énantiomère S actif de la vigabatrine chez les nourrissons et les enfants était de 0,591 L/h/kg et de 0,446 L/h/kg respectivement.
Dosage
Dosage - VIGABATRINE - voie orale
Granulés pour solution buvable
Le traitement par VIGABATRINE ne peut être instauré que par un spécialiste en épileptologie, neurologie ou neurologie pédiatrique. Le suivi doit être assuré sous la supervision d'un spécialiste en épileptologie, neurologie ou neurologie pédiatrique.
Posologie
VIGABATRINE est destiné à une administration par voie orale, en une ou deux prises quotidiennes avant ou après les repas.
Le contenu du ou des sachets doit être dissout dans une boisson (eau, jus de fruits ou lait) immédiatement avant administration.
Si, après un essai de traitement bien conduit, la vigabatrine ne procure pas une amélioration cliniquement significative des manifestations de l'épilepsie, le traitement ne doit pas être poursuivi. Le traitement par la vigabatrine doit être arrêté progressivement sous étroite surveillance médicale.
Chez l'adulte
L'efficacité maximale est généralement obtenue avec une posologie quotidienne comprise entre 2 et 3 g. Le traitement est instauré à une posologie quotidienne de 1 g en complément du traitement antiépileptique du patient. La dose quotidienne doit ensuite être augmentée par paliers de 0,5 g à intervalles d'une semaine en fonction de la réponse clinique et de la tolérance. La dose maximale recommandée est de 3 g/jour.
Il n'y a pas de corrélation entre la concentration plasmatique et l'efficacité. La durée d'action du produit dépend du taux de re-synthèse de la GABA-transaminase et non de la concentration plasmatique du produit .
Population pédiatrique
Traitement des épilepsies partielles résistantes
La dose initiale recommandée chez le nouveau-né, l'enfant et l'adolescent est de 40 mg/kg/jour. Les recommandations sur la base du poids corporel pour le traitement d'entretien sont les suivantes :
Poids corporel | Posologie |
10 - 15 kg | 0,5 - 1 g/j |
15 - 30 kg | 1 - 1,5 g/j |
30 - 50 kg | 1,5 - 3 g/j |
> 50 kg | 2 - 3 g/j |
La posologie maximale recommandée pour chacune des catégories de poids corporel ne doit pas être dépassée.
Traitement en monothérapie des spasmes infantiles (syndrome de West) :
La posologie initiale recommandée est de 50 mg/kg/jour. Cette posologie peut être atteinte par une augmentation progressive sur une période d'une semaine, si nécessaire. Des doses allant jusqu'à 150 mg/kg/jour ont été bien tolérées.
Chez la personne âgée et chez l'insuffisant rénal
La vigabatrine étant éliminée par voie rénale, une attention particulière doit être apportée lors de son administration chez la personne âgée et, plus particulièrement, lorsque la clairance de la créatinine est inférieure à 60 ml/min. Un ajustement de la dose ou de la fréquence d'administration doit être envisagé. Ces patients sont susceptibles de répondre à une dose d'entretien plus faible. Ils doivent faire l'objet d'une surveillance particulière à la recherche d'éventuels effets indésirables à type de sédation ou de confusion .
Le traitement par VIGABATRINE ne peut être instauré que par un spécialiste en épileptologie, neurologie ou neurologie pédiatrique. Le suivi doit être assuré sous la supervision d'un spécialiste en épileptologie, neurologie ou neurologie pédiatrique.
Posologie
VIGABATRINE est destiné à une administration par voie orale, en une ou deux prises quotidiennes avant ou après les repas.
Si, après un essai de traitement bien conduit, la vigabatrine ne procure pas une amélioration cliniquement significative des manifestations de l'épilepsie, le traitement ne doit pas être poursuivi. Le traitement par la vigabatrine doit être arrêté progressivement sous étroite surveillance médicale.
La forme comprimé n'est pas adaptée à l'enfant de moins de 6 ans en raison du risque de fausse route.
Chez l'adulte
L'efficacité maximale est généralement obtenue avec une posologie quotidienne comprise entre 2 et 3 g. Le traitement est instauré à une posologie quotidienne de 1 g en complément du traitement antiépileptique du patient. La dose quotidienne doit ensuite être augmentée par paliers de 0,5 g à intervalles d'une semaine en fonction de la réponse clinique et de la tolérance. La dose maximale recommandée est de 3 g/jour.
Il n'y a pas de corrélation entre la concentration plasmatique et l'efficacité. La durée d'action du produit dépend du taux de re-synthèse de la GABA-transaminase et non de la concentration plasmatique du produit .
Population pédiatrique
Traitement des épilepsies partielles résistantes
La dose initiale recommandée chez le nouveau-né, l'enfant et l'adolescent est de 40 mg/kg/jour. Les recommandations sur la base du poids corporel pour le traitement d'entretien sont les suivantes :
Poids corporel | Posologie |
10 - 15 kg | 0,5 - 1 g/j |
15 - 30 kg | 1 - 1,5 g/j |
30 - 50 kg | 1,5 - 3 g/j |
> 50 kg | 2 - 3 g/j |
La posologie maximale recommandée pour chacune des catégories de poids corporel ne doit pas être dépassée.
Traitement en monothérapie des spasmes infantiles (syndrome de West) :
La posologie initiale recommandée est de 50 mg/kg/jour. Cette posologie peut être atteinte par une augmentation progressive sur une période d'une semaine, si nécessaire. Des doses allant jusqu'à 150 mg/kg/jour ont été bien tolérées.
Chez la personne âgée et chez l'insuffisant rénal
La vigabatrine étant éliminée par voie rénale, une attention particulière doit être apportée lors de son administration chez la personne âgée et, plus particulièrement, lorsque la clairance de la créatinine est inférieure à 60 ml/min. Un ajustement de la dose ou de la fréquence d'administration doit être envisagé. Ces patients sont susceptibles de répondre à une dose d'entretien plus faible. Ils doivent faire l'objet d'une surveillance particulière à la recherche d'éventuels effets indésirables à type de sédation ou de confusion .
Indications
Indications - VIGABATRINE - usage systémique
En association avec un autre traitement antiépileptique, traitement des épilepsies partielles résistantes, avec ou sans généralisation secondaire, lorsque toutes les autres associations thérapeutiques appropriées se sont révélées insuffisantes ou mal tolérées.
Traitement en monothérapie des spasmes infantiles (syndrome de West).
Effets indésirables
Effets indésirables - VIGABATRINE - usage systémique
Résumé des données de sécurité
Des anomalies du champ visuel d'intensité légère à sévère ont été fréquemment rapportées chez les patients traités par la vigabatrine. Les cas sévères sont potentiellement invalidants. Ces anomalies apparaissent généralement après quelques mois ou années de traitement par la vigabatrine. Le regroupement de données issues des enquêtes de prévalence suggère qu'un tiers des patients traités par la vigabatrine présente des anomalies du champ visuel .
Lors des études cliniques contrôlées, environ 50 % des patients ont présenté des effets indésirables au cours du traitement par la vigabatrine. Chez l'adulte, les principaux effets indésirables sont en relation avec le système nerveux central, à type de sédation, somnolence, fatigue et troubles de la concentration. Chez l'enfant, en revanche, les cas d'excitation ou d'agitation sont fréquents. L'incidence de ces effets indésirables est généralement plus élevée au début du traitement et diminue ensuite.
Comme avec tout antiépileptique, certains patients traités par la vigabatrine peuvent présenter une augmentation de la fréquence des crises, voire un état de mal épileptique. Les patients qui présentent des crises myocloniques sont particulièrement susceptibles de présenter cet effet. L'apparition de novo d'une myoclonie ou l'aggravation d'une myoclonie préexistante a été observée dans de rares cas.
Tableau sommaire des effets indésirables
| Très fréquent | Fréquent | Peu fréquent | Rare | Très rare | Fréquence indéterminée |
Affections hématologiques et du système lymphatique | | anémie | | | | |
Affections psychiatriques* | | agitation, agressivité, nervosité, dépression, réaction paranoïde, insomnie | hypomanie, manie, troubles psychotiques | tentative de suicide | hallucinations | |
Affections du système nerveux | somnolence | troubles de l'élocution, céphalées, étourdisse-ments, paresthésies, troubles de l'attention et de la mémoire, diminution des facultés mentales (troubles de l'idéation), tremblements | troubles de la coordination (ataxie) | encéphalopa-thie** | névrite optique | des cas d'anomalies cérébrales ont été rapportés à l'IRM . mouvements anormaux, incluant dystonie, dyskinésie et hypertonie, isolées ou associées à des anomalies de l'IRM ont été rapportés . |
Affections oculaires | anomalies du champ visuel | vision trouble, vision double, nystagmus | | affections rétiniennes (par ex. atrophie rétinienne périphérique) | atrophie du nerf optique | |
Affections gastro-intestinales | | nausées, vomissements, douleur abdominale | | | | |
Affections hépatobiliaires | | | | | hépatite | |
Affections de la peau et du tissu sous-cutané | | alopécie | éruption | dème de Quincke, urticaire | | |
Affections musculo-squelettiques et systémiques | arthralgie | | | | | |
Troubles généraux et anomalies au site d'administra-tion | fatigue | dème, irritabilité | | | | |
Investigations*** | | prise de poids | | | | |
*Des réactions psychiatriques ont été rapportées sous traitement par la vigabatrine. Ces réactions ont été observées chez des patients avec ou sans antécédents psychiatriques et elles ont généralement été réversibles en cas de réduction de la posologie ou d'arrêt progressif du traitement . La dépression est une réaction psychiatrique qui a été fréquemment observée au cours des essais cliniques, mais elle n'a que rarement nécessité l'arrêt du traitement par la vigabatrine.
** De rares cas de symptômes d'encéphalopathie, à type de sédation prononcée, stupeur ou confusion, associés à la présence non spécifique d'ondes lentes à l'électroencéphalogramme, ont été décrits peu de temps après le début du traitement par la vigabatrine. Ces réactions se sont révélées totalement réversibles après une réduction de la posologie ou à l'arrêt de la vigabatrine .
*** Les résultats des examens biologiques indiquent que le traitement par la vigabatrine ne provoque pas de néphrotoxicité. Des baisses de l'ALAT et de l'ASAT, considérées comme le résultat de l'inhibition de ces aminotransférases par la vigabatrine, ont été observées.
Population pédiatrique
Affections psychiatriques
Très fréquent : excitation, agitation.
Surdosage
Symptômes
Des cas de surdosage de vigabatrine ont été rapportés. Quand elles étaient connues, les doses étaient le plus souvent comprises entre 7,5 et 30 g, mais des surdosages atteignant 90 g ont également été signalés. Dans près de la moitié des cas, il s'agissait d'ingestions médicamenteuses multiples. Les symptômes les plus fréquemment rapportés ont été une somnolence ou un coma.
D'autres symptômes ont été rapportés moins fréquemment et notamment vertiges, céphalées, psychose, dépression respiratoire ou apnée, bradycardie, hypotension artérielle, agitation, irritabilité, confusion, troubles du comportement, troubles de l'élocution. Aucun des cas de surdosage n'a eu d'issue fatale.
Conduite à tenir
Il n'y a pas d'antidote spécifique. Les mesures symptomatiques habituelles doivent être prises. Des mesures visant à éliminer le produit non encore absorbé doivent être envisagées. Dans une étude in vitro le charbon activé n'a pas adsorbé de manière significative la vigabatrine. L'efficacité de l'hémodialyse dans le traitement du surdosage en vigabatrine n'est pas connue. Dans des cas isolés chez des patients insuffisants rénaux traités par des doses thérapeutiques de vigabatrine, l'hémodialyse a réduit les concentrations plasmatiques de vigabatrine de 40 à 60 %.
Interactions avec d'autres médicaments
Comme la vigabatrine n'est ni métabolisée, ni liée aux protéines, ni inducteur d'enzymes hépatiques à cytochrome P450 responsables du métabolisme des médicaments, il y a peu de risque d'interaction avec d'autres médicaments. Toutefois, une réduction progressive des concentrations plasmatiques de phénytoïne atteignant 16 à 33 % a été rapportée lors des études cliniques contrôlées. Le mécanisme précis de cette interaction n'est pas connu et, dans la majorité des cas, la conséquence clinique est peu probable.
Les concentrations plasmatiques de carbamazépine, de phénobarbital et de valproate de sodium ont également été surveillées lors des essais cliniques contrôlés et aucune interaction cliniquement significative n'a été observée.
La vigabatrine peut entraîner une diminution des taux plasmatiques d'alanine aminotransférase (ALAT) et, dans une moindre mesure, des taux plasmatiques d'aspartate aminotransférase (ASAT). La variation de la diminution de l'ALAT s'est située entre 30 et 100 %. Ces tests hépatiques peuvent donc ne pas être fiables du point de vue quantitatif chez les patients traités par la vigabatrine .
La vigabatrine peut entraîner une augmentation des taux d'acides aminés dans les urines pouvant se traduire par des faux positifs lors des examens de dépistage de certaines affections métaboliques génétiques rares (p.ex. acidurie alpha-aminoadipique).
L'utilisation concomitante de vigabatrine et clonazepam peut exacerber les effets sédatifs .

 Français
Français Русский
Русский