Pharmacodynamique
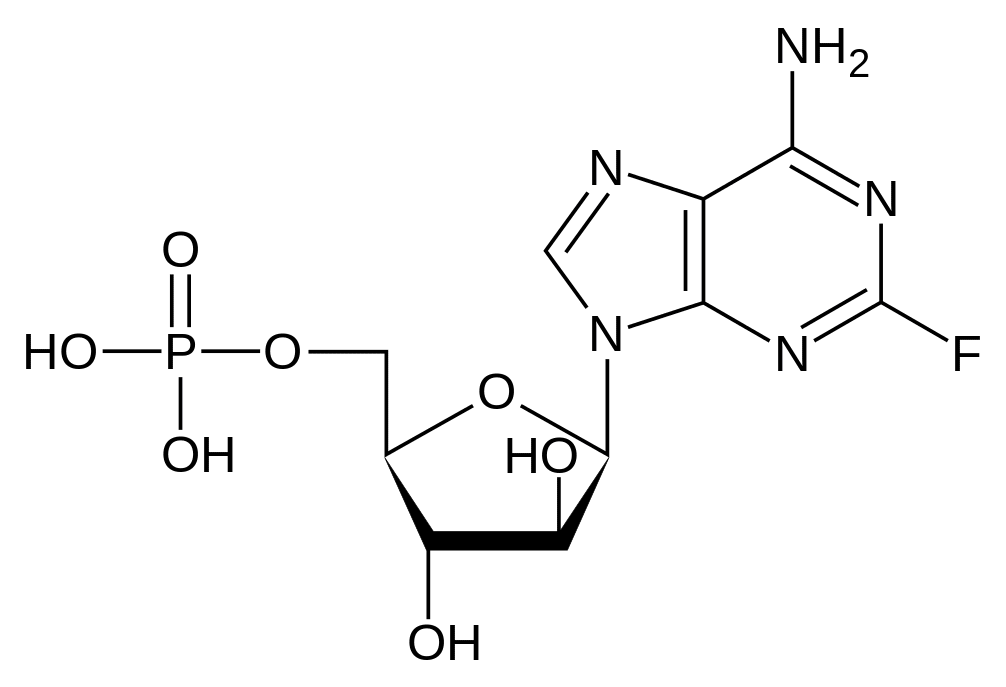
La Fludarabine est un nucléotide fluoré hydrosoluble analogue de l'agent antiviral vidarabine, 9-β-D-arabinofuranosyladénine (ara-A), qui est relativement résistant à la désamination par l'adénosine désaminase.
Le phosphate de fludarabine est rapidement déphosphorylé en 2-F-ara-A qui est incorporé dans la cellule puis subit une phosphorylation intracellulaire par la déoxycytidine kinase, en triphosphate actif, le 2-F-ara-ATP. Il a été montré que ce métabolite agit en inhibant la ribonucléotide réductase, l'ADN polymérase α/δ et ε, l'ADN primase et l'ADN ligase, inhibant ainsi la synthèse de l'ADN.
De plus, en raison d'une inhibition partielle de l'ARN polymérase II, il se produit une importante inhibition de la synthèse des protéines.
Bien que certains aspects du mécanisme d'action de la 2-F-ara-ATP demeurent encore obscurs, il est établi que ses effets sur l'ADN, l'ARN et la synthèse des protéines contribuent tous à l'inhibition de la croissance de la cellule, l'inhibition de la synthèse de l'ADN étant le facteur prédominant.
De plus, des études in vitro ont montré que l'exposition de lymphocytes de LLC au 2F-ara-A déclenchait une fragmentation importante de l'ADN et une mort cellulaire caractéristique de l'apoptose.
Pharmacocinétique
Pharmacocinétique - FLUDARABINE - usage parentéral
Pharmacocinétique plasmatique et urinaire de la fludarabine (2-F-ara-A)
Les propriétés pharmacocinétiques de la fludarabine (2F-ara-A) ont été étudiées après administration intraveineuse en bolus, en perfusion de courte durée ou en perfusion continue, de phosphate de fludarabine (fludarabine, 2F-ara-AMP).
Le 2F-ara-AMP est une prodrogue hydrosoluble, qui est rapidement et complétement déphosphorylée chez l'homme en nucléoside fludarabine (2F-ara-A). Après perfusion d'une dose unique pendant 30 mn de 25 mg/m2 de 2F-ara-AMP à des patients cancéreux, le 2F-ara-A atteint une concentration plasmatique maximum moyenne de 3,5 - 3,7 µM à la fin de la perfusion.
Après une cinquième dose, les concentrations de 2F-ara-A montrent une accumulation modérée avec des valeurs de 4,4-4,8 µM à la fin de la perfusion. Pendant un traitement de 5 jours, les concentrations plasmatiques minimales de 2F-ara-A augmentent d'un facteur 2 environ. Une accumulation de 2F-ara-A au cours de plusieurs cycles de traitement peut être exclue.
Après le pic maximal, les concentrations diminuent en 3 phases, avec une demi-vie initiale d'à peu près 5 min, une demi-vie intermédiaire de 1 à 2 heures et une demi-vie terminale d'environ 20 heures.
Une comparaison inter-études des propriétés pharmacocinétiques du 2F-ara-A montre une clairance plasmatique totale moyenne (CL) de 79 ± 40 ml/min/m2 (2,2 ± 1,2 ml/min/kg) et un volume moyen de distribution (Vss) de 83 ± 55 l/m2 (2,4 ± 1,6 l/kg). Les données montrent une grande variabilité interindividuelle.
Les taux plasmatiques de 2F-ara-A et les aires sous la courbe augmentent de façon linéaire avec la dose alors que les demi-vies, la clairance plasmatique et les volumes de distribution sont indépendants de la dose, indiquant une pharmacocinétique dose-linéaire.
La survenue d'une neutropénie et de modifications de l'hématocrite témoignent d'une toxicité dose dépendante du phosphate de fludarabine sur l'hématopoïèse.
L'élimination de la 2F-ara-A se fait principalement par voie rénale. Quarante à soixante % de la dose IV administrée a été excrétée dans les urines. Des études d'équilibre des masses (« masse balance ») chez l'animal avec du 3H-2F-ara AMP ont montré une complète restitution des substances radiomarquées dans les urines. Un autre métabolite, la 2F-ara-hypoxanthine, métabolite principal chez le chien, a été retrouvé en faible quantité chez l'homme.
Chez certains sujets dont la fonction rénale était altérée, il a été montré une réduction de la clairance corporelle totale, indiquant la nécessité d'une réduction des posologies. Les études in vitro n'ont pas mis en évidence une forte liaison aux protéines plasmatiques humaines du 2F-ara-A.
Pharmacocinétique cellulaire du triphosphate de fludarabine
Le 2F-ara-A est transporté activement dans les cellules leucémiques, où il est rephosphorylé en monophosphate puis en di-et tri-phosphate. Le triphosphate 2F-ara-ATP est le principal métabolite intracellulaire et le seul métabolite connu pour avoir une activité cytotoxique.
Les taux maximum de 2F-ara-ATP dans les lymphocytes leucémiques des patients atteints de LLC ont été observés après un délai médian de 4 heures et ont montré une variabilité considérable avec un pic de concentration médian approximativement égal à 20 µM.
Les taux de 2F-ara-ATP dans les cellules leucémiques ont toujours été considérablement plus élevés que les taux maximums de 2F-ara-A dans le plasma, indiquant une accumulation au niveau des sites cibles.
L'incubation in vitro de lymphocytes leucémiques montre une relation linéaire entre l'exposition au 2F-ara-A (résultant de la concentration en 2F-ara-A et de la durée de l'incubation) et l'enrichissement intracellulaire en 2F-ara-ATP. L'élimination du 2F-ara-ATP des cellules cibles se fait selon une demi-vie médiane de 15 à 23 heures.
Il n'a pas été montré de corrélation claire entre les propriétés pharmacocinétiques du 2F-ara-A et l'efficacité du traitement chez les patients.
Dosage
Dosage - FLUDARABINE - usage parentéral
Poudre pour solution injectable ou pour perfusion
La fludarabine doit être administrée sous la surveillance d'un spécialiste expérimenté dans l'utilisation des agents antinéoplasiques.
Il est fortement recommandé d'administrer la fludarabine uniquement par voie intraveineuse. Il n'a été rapporté aucun cas de réaction locale sévère à la suite d'une administration de la fludarabine paraveineuse. Cependant, une administration paraveineuse accidentelle doit être évitée.
Adultes
La dose recommandée est de 25 mg/m2/j de surface corporelle, administrée par voie intraveineuse, en cure de 5 jours consécutifs tous les 28 jours.
La solution est reconstituée avec 2 ml d'eau pour préparations injectables. Chaque ml de cette solution reconstituée contient 25 mg de phosphate de fludarabine.
La dose nécessaire de solution reconstituée (calculée sur la base de la surface corporelle du patient) est prélevée à la seringue.
Pour une injection intraveineuse en bolus, diluer ensuite cette dose dans 10 ml de chlorure de sodium à 0,9 %;
La durée optimale du traitement n'est pas clairement établie. Elle dépend de l'efficacité du traitement et de la tolérance au produit. Il est recommandé d'administrer FLUDARABINE jusqu'à l'obtention d'une réponse maximale (en général 6 cycles), ensuite le traitement sera interrompu;
Insuffisance hépatique
Insuffisance hépatique
Aucune donnée n'est disponible concernant l'usage de la fludarabine chez les patients insuffisants hépatiques. Chez ce groupe de patients, la fludarabine doit être utilisée avec précaution et administrée si le bénéfice attendu dépasse tout risque potentiel.
Insuffisance rénale
La clairance totale du principal métabolite plasmatique 2F-ara-A est corrélée à celle de la créatinine sérique, ce qui démontre l'importance de l'excrétion rénale pour l'élimination du produit. Chez l'insuffisant rénal, une augmentation de l'exposition corporelle totale a été démontrée (AUC du 2F-ara-A). Peu de données cliniques sont disponibles chez l'insuffisant rénal (clairance de la créatine sérique < 70 ml/min). Il est donc nécessaire de mesurer la clairance de la créatinine si une insuffisance rénale est suspectée ou chez les patients de plus de 70 ans. Si la clairance de la créatinine sérique est comprise entre 30 et 70 ml/min, la posologie doit être réduite jusqu'à 50 % et une surveillance hématologique étroite doit être instaurée pour évaluer la toxicité. Le traitement par la fludarabine est contre-indiqué si la clairance de la créatinine sérique est inférieure à 30 ml/min.
Enfants
L'utilisation de la fludarabine chez l'enfant n'est pas recommandée du fait de l'absence de données sur la sécurité et/ou l'efficacité.
Indications
Indications - FLUDARABINE - usage systémique
Traitement de la leucémie lymphoïde chronique (LLC) à cellules B chez les patients ayant des réserves médullaires suffisantes.
Le traitement en première ligne par la fludarabine doit uniquement être initié chez les patients en stade avancé de la maladie, Raï stade III/IV (Binet stade C) ou Raï stade I/II (Binet stade A/B) lorsque le patient présente des symptômes associés à la maladie ou une maladie en progression.
Contre-indications
La fludarabine est contre-indiquée:
chez les patients présentant une hypersensibilité au principe actif ou à l'un des excipients;
chez les patients présentant une insuffisance rénale avec une clairance de la créatinine < 30 ml/min;
chez les patients présentant une anémie hémolytique décompensée;
en cas de grossesse et d'allaitement .
Effets indésirables
Effets indésirables - FLUDARABINE - usage systémique
Les effets indésirables les plus fréquents sont: myélosuppression (neutropénie, thrombocytopénie, anémie), infection y compris pneumonie, fièvre, nausées, vomissements et diarrhée.
Autres effets indésirables fréquents: sensation de malaise, faiblesse, fatigue, stomatites, anorexie, dèmes, frissons, neuropathie périphérique, troubles visuels et rash cutané. Des infections opportunistes sévères sont survenues chez des patients traités par FLUDARABINE MYLAN. Des décès ont été rapportés à des effets indésirables graves.
Les effets indésirables les plus fréquemment observés et les plus clairement imputables au produit sont décrits ci-dessous indépendamment de leur sévérité. Leurs fréquences (fréquent ≥ 1 %, peu fréquent ≥ 0,1 % et < 1 %) ont été établies à partir des données cliniques, indépendamment du lien de causalité avec la fludarabine.
Les événements rares (< 0,1 %) ont principalement été identifiés au cours de la pharmacovigilance.
Ensemble du corps
Infection, fièvre, fatigue, faiblesse, sensation de malaise et frissons ont été fréquemment rapportés
Système hématopoïétique et lymphoïde
Chez la plupart des patients traités par la fludarabine, des anomalies hématologiques (neutropénie, thrombopénie et anémie) ont été rapportées. La myélosuppression peut être sévère et cumulative.
L'effet prolongé de la fludarabine sur la diminution du nombre de lymphocytes T peut augmenter le risque d'infections opportunistes, y compris celles dues à la réactivation de virus latents telles qu'une infection due à l'herpès virus, au virus d'Epstein Barr (EBV) ou une leucoencéphalopathie multifocale progressive . Une évolution de l'infection EBV / une réactivation EBV associée à des désordres lymphoprolifératifs a été observée chez les patients immunodéprimés.
Dans de rares cas, la survenue de syndrome myélodysplasique a été décrite chez des patients traités par la fludarabine. La majorité de ces patients avait reçu au préalable, concomitamment ou ultérieurement, un traitement avec des agents alkylants ou une irradiation. La fludarabine utilisée en monothérapie, n'a pas été associée à un risque accru de syndrome myélodysplasique.
Des phénomènes auto-immuns avec retentissement clinique ont été rapportés de manière peu fréquente chez les patients recevant la fludarabine (voir paragraphe 4.4).
Troubles du métabolisme et de la nutrition
Un syndrome de lyse tumorale a été rapporté de manière peu fréquente chez des patients traités par la fludarabine pouvant comporter: hyperuricémie, hyperphosphatémie, hypocalcémie, acidose métabolique, hyperkaliémie, hématurie, excrétion de cristaux d'urate, insuffisance rénale. La survenue de ce syndrome peut être marquée par une douleur lombaire et une hématurie.
Des dèmes ont fréquemment été rapportés.
Des modifications des enzymes pancréatiques et hépatiques sont peu fréquentes.
Troubles du système nerveux
Des neuropathies périphériques ont été fréquemment observées. Peu de cas de confusion ainsi que de rares cas de coma, d'agitation et des crises convulsives ont été rapportés.
Troubles occulaires
Des troubles visuels ont été rapportés fréquemment chez les patients traités par la fludarabine. Dans de rares cas, des névrites optiques, des neuropathies optiques et une cécité sont survenues.
Troubles respiratoires, thoraciques et médiastinaux
Des pneumonies sont fréquemment survenues, associées au traitement par la fludarabine.
Des réactions d'hypersensibilité pulmonaire à la fludarabine (pneumopathie, infiltrat pulmonaire interstitiel et/ou fibrose) associées à une dyspnée et une toux ont été observées avec la fludarabine.
Troubles gastro-intestinaux
Des troubles gastro-intestinaux tels que nausées et vomissements, diarrhée, stomatite et anorexie sont des effets indésirables fréquents. Des hémorragies gastro-intestinales principalement dues à une thrombocytopénie ont été rapportées de manière peu fréquente chez des patients traités par la fludarabine.
Troubles cardiaques
De rares cas d'insuffisance cardiaque et d'arythmie ont été rapportés chez les patients traités par la fludarabine.
Troubles rénaux et urinaires
De rares cas de cystites hémorragiques ont été rapportés chez les patients traités par la fludarabine.
Troubles cutanés et du tissu sous-cutané
Des éruptions cutanées ont été fréquemment rapportées chez les patients traités par la fludarabine.
Dans de rares cas, un syndrome de Stevens-Johnson et une épidermolyse toxique (syndrome de Lyell) peuvent survenir.
Surdosage
De fortes doses de fludarabine ont été accompagnées d'une toxicité irréversible du système nerveux central, caractérisée par une cécité retardée, un coma, et le décès. Les fortes doses ont également été associées à des thrombocytopénies sévères et neutropénies dues à une myélosuppression. Il n'existe pas d'antidote connu du surdosage par la fludarabine. Le traitement des manifestations de surdosage est limité à l'arrêt du traitement et à la mise en uvre d'une thérapeutique symptomatique.
Grossesse/Allaitement
Grossesse
FLUDARABINE ne doit pas être utilisé pendant la grossesse. Les femmes en âge de procréer doivent éviter une grossesse et avertir immédiatement le médecin traitant en cas de survenue d'une grossesse.
L'expérience très limitée dans l'espèce humaine corrobore les résultats des études d'embryotoxicité chez l'animal qui ont montré un potentiel embryotoxique et/ou tératogène aux doses thérapeutiques. Les études chez le rat ont montré que le phosphate de fludarabine et/ou des métabolites traversaient la barrière ftoplacentaire.
Allaitement
L'allaitement doit être interrompu pendant la durée du traitement de FLUDARABINE .
L'existence d'un passage dans le lait maternel n'est pas connue.
Les études pré-cliniques ont montré que le phosphate de fludarabine et/ou ses métabolites passaient dans le lait materne
Interactions avec d'autres médicaments
Au cours d'un essai clinique utilisant la fludarabine en association avec la pentostatine (déoxycoformycine) dans le traitement des LLC réfractaires, on a observé une fréquence inacceptable d'accidents pulmonaires mortels. En conséquence, l'association de fludarabine et de pentostatine n'est pas recommandée.
Il existe un risque de diminution de l'efficacité de la fludarabine en cas d'association au dipyridamole ou à d'autres inhibiteurs du captage de l'adénosine.
Une interaction pharmacocinétique entre le phosphate de fludarabine et l'Aracytine (Ara-C, cytarabine) a été observée chez les patients atteints de LLC et de LAM. Des études cliniques et des études réalisées in vitro sur des lignées cellulaires cancéreuses ont montré une augmentation des taux intracellulaires d'Ara-CTP dans les cellules leucémiques en terme de pic de concentrations intracellulaires et d'exposition intracellulaire (AUC), après un traitement par la fludarabine puis par Ara-C. Les concentrations plasmatiques d'Ara-C et les taux d'élimination d'Ara-CTP n'ont pas été modifiés.

 Français
Français Русский
Русский