Pharmacodynamique
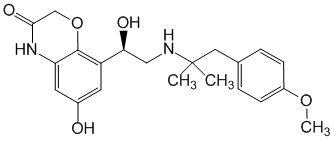
L'olodatérol présente une affinité et une sélectivité élevées pour les récepteurs β2-adrénergiques humains.
Des études in vitro ont montré que l'olodatérol présente une activité agoniste plus élevée sur les récepteurs β2-adrénergiques que sur les récepteurs β1-adrénergiques (241-fois supérieure) ainsi que sur les récepteurs β3- adrénergiques (2 299-fois supérieure).
L'olodatérol, administré par voie inhalée, exerce ses effets pharmacologiques par liaison et activation des récepteurs β2-adrénergiques.
L'activation de ces récepteurs au niveau des voies aériennes respiratoires entraîne une stimulation de l'adénylcyclase intracellulaire, une enzyme impliquée dans la synthèse du 3',5'‑adénosine monophosphate cyclique (cAMP). Des taux élevés de cAMP entraînent une bronchodilatation par relaxation des muscles lisses des voies respiratoires.
Le profil des caractéristiques non-cliniques de l'olodatérol est celui d'un agoniste des récepteurs β2- adrénergiques sélectif de longue durée d'action (LABA) ayant un début d'action rapide et une durée d'action d'au moins 24 heures.
Les récepteurs β-adrénergiques sont divisés en trois catégories : les récepteurs β1-adrénergiques, exprimés principalement au niveau du muscle cardiaque lisse, les récepteurs β2-adrénergiques exprimés principalement au niveau des muscles lisses des voies respiratoires et les récepteurs β3-adrénergiques exprimés principalement au niveau du tissu adipeux. L'action des agonistes β2 entraîne un effet bronchodilatateur. Bien que le récepteur β2 soit le principal récepteur β-adrénergique présent au niveau des muscles lisses des voies respiratoires, il est aussi présent à la surface de diverses autres cellules telles que les cellules épithéliales et endothéliales pulmonaires, ainsi qu'au niveau du coeur. L'activité des récepteurs β2 cardiaques n'est pas connue avec précision mais du fait de leur présence, il existe une possibilité que même des agonistes β2-adrénergiques hautement sélectifs puissent entraîner des effets cardiaques.
Effets sur l'électrophysiologie cardiaque
L'effet de l'olodatérol sur l'intervalle QT/QTc de I'ECG a été étudié chez 24 hommes et femmes volontaires sains dans une étude en double aveugle randomisée, contrôlée contre placebo et comparateur actif (moxifloxacine). L'inhalation d'olodatérol en doses uniques de 10, 20, 30 et 50 mcg, a entraîné, sur la période de 20 minutes à 2 heures suivant l'administration, une augmentation dose-dépendante moyenne de l'espace QT par rapport à la valeur initiale de 1,6 ms (10 mcg d'olodatérol) à 6,5 ms (50 mcg d'olodatérol) comparativement au placebo. La limite supérieure des intervalles de confiance à 90 % bilatéraux étaient inférieurs à 10 ms pour toutes les doses pour l'espace QT corrigé (QTc).
L'effet de 5 mcg et de 10 mcg de OLODATÉROL sur la fréquence et le rythme cardiaques a été évalué par électrocardiogramme (ECG) continu sur 24 heures (Holter) dans un sous-groupe de 772 patients dans les essais de phase Ill de 48 semaines contrôlés contre placebo. Il n'a pas été observé de tendance liée à la dose ou au temps pour les modifications moyennes de la fréquence cardiaque ou pour la survenue d'extrasystoles. Il n'a pas été mis en évidence de différence significative sur la survenue d'extrasystoles entre l'état initial et la fin du traitement entre l'administration de l'olodatérol 5 mcg, de l'olodatérol 10 mcg et du placebo.
Pharmacocinétique
Pharmacocinétique - OLODATÉROL - voie inhalée
Introduction générale
Les données pharmacocinétiques concernant l'olodatérol sont issues d'études conduites chez des volontaires sains, des patients présentant une BPCO et des patients atteints d'asthme recevant par voie inhalée des doses égales ou supérieures à la dose thérapeutique.
La pharmacocinétique de l'olodatérol est linéaire et montre une augmentation de l'exposition systémique proportionnelle à la dose administrée par voie inhalée pour des doses uniques de 5 à 70 mcg et pour des doses quotidiennes uniques répétées de 2 à 20 mcg.
Après administration répétée d'une dose unique quotidienne, l'état d'équilibre des concentrations plasmatiques d'olodatérol a été atteint en 8 jours avec une exposition systémique augmentée d'un facteur de 1,8 par rapport à l'administration d'une seule dose.
Caractéristiques générales de la substance active après administration du médicament.
Absorption
Les concentrations plasmatiques maximales d'olodatérol sont généralement atteintes en 10 à 20 minutes après inhalation du médicament. Chez les volontaires sains, la biodisponibilité absolue de l'olodatérol après inhalation est estimée à environ 30 %, contre moins de 1 % après administration en solution orale. Ainsi, la disponibilité systémique de l'olodatérol après inhalation est principalement déterminée par l'absorption pulmonaire.
Distribution
La cinétique d'élimination de l'olodatérol après inhalation et après administration intraveineuse est multicompartimentale. Le volume de distribution tissulaire est élevé (1 110 L) indiquant une distribution tissulaire importante. ln vitro, la liaison de [14C] olodatérol aux protéines plasmatiques de l'ordre de 60 % est indépendante de la concentration.
L'olodatérol est un substrat des transporteurs P-gp, OAT1, OAT3 et OCT1. L'olodatérol n'est pas un substrat des transporteurs suivants: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 et OCT3.
Biotransformation
L'olodatérol est métabolisé principalement par glucuronidation directe et par O-déméthylation au niveau du groupement méthoxy puis par conjugaison. Parmi les six métabolites identifiés, seul le composé déméthylé non conjugué se lie aux récepteurs β2. Toutefois, ce métabolite n'est pas détectable dans le plasma après inhalation chronique de la dose thérapeutique recommandée ou de doses jusqu'à 4-fois supérieures. L'olodatérol est donc considéré comme étant le seul composé pharmacologiquement actif.
Les isoenzymes CYP2C9 et CYP2C8 du cytochrome P450 et, dans une moindre mesure, l'isoenzyme CYP3A4, sont impliquées dans la O-déméthylation de l'olodatérol, tandis qu'il a été montré que les isoformes UGT2B7, UGT1A1, 1A7 et 1A9 de l'uridine diphosphate glycosyl transférase sont impliquées dans la formation de glucuronides de l'olodatérol.
Élimination
Chez les sujets sains, la clairance totale de l'olodatérol est de 872 mL/min et sa clairance rénale est de 173 mL/min.
Après administration intraveineuse de l'olodatérol marqué au [C14], 38 % de la dose radioactive a été retrouvée dans l'urine et 53 % dans les selles. La quantité d'olodatérol sous forme inchangée retrouvée dans l'urine après administration intraveineuse était de 19 %. Après administration orale, seulement 9 % de la radioactivité (0,7 % d'olodatérol sous forme inchangée) a été retrouvée dans l'urine, la plus grande partie ayant été retrouvée dans les selles (84 %). Plus de 90 % de la dose ont été excrétés dans les 6 jours suivant l'administration par voie intraveineuse et dans les 5 jours suivant l'administration par voie orale. A l'état d'équilibre après inhalation chez les volontaires sains, 5 à 7 % de la dose d'olodatérol administrée ont été excrétés par voie urinaire sous forme inchangée.
Les concentrations plasmatiques d'olodatérol après inhalation diminuent de façon multiphasique, avec une demi-vie terminale d'environ 45 heures.
Populations spécifiques
Une méta-analyse des données de pharmacocinétique a été réalisée à partir de 2 études cliniques contrôlées incluant 405 patients atteints de BPCO et 296 patients asthmatiques traités avec OLODATÉROL.
Cette analyse conduite sur l'exposition systémique a montré qu'il n'est pas nécessaire d'adapter la dose en fonction de l'âge, du sexe ou du poids chez les patients atteints de BPCO après inhalation de OLODATÉROL.
Insuffisance rénale
Il n'a pas été observé d'augmentation cliniquement significative de l'exposition systémique chez les patients insuffisants rénaux.
Insuffisance hépatique
Il n'a pas été observé de différence sur l'élimination de l'olodatérol ou sur sa liaison aux protéines plasmatiques de l'olodatérol entre les sujets atteints d'insuffisance hépatique légère ou modérée et des sujets témoins sans insuffisance hépatique. Il n'y a pas d'étude chez des sujets atteints d'insuffisance hépatique sévère.
Origine ethnique
Une comparaison des données pharmacocinétiques dans les études et entre les études a révélé une tendance à une exposition systémique plus élevée chez les sujets japonais et originaires d'autres pays asiatiques par rapport aux sujets caucasiens.
Il n'a pas été identifié de problème de sécurité d'emploi dans les études cliniques incluant des sujets caucasiens et asiatiques jusqu'à un an de traitement avec OLODATÉROL à des doses allant jusqu'à deux fois la dose thérapeutique préconisée.
Dosage
Dosage - OLODATÉROL - voie inhalée
Solution
Voie inhalée exclusivement.
La cartouche ne peut être insérée et utilisée qu'avec l'inhalateur RESPIMAT.
Une dose journalière correspond à deux pressions (bouffées) consécutives administrées à l'aide de l'inhalateur RESPIMAT.
Adultes
La posologie recommandée est de 5 mcg d'olodatérol, soit deux pressions (bouffées) consécutives administrées à l'aide de l'inhalateur RESPIMAT, en une prise par jour à heure fixe dans la journée.
Ne pas dépasser la posologie recommandée.
Sujets âgés
OLODATÉROL peut être utilisé chez les sujets âgés sans adaptation de la posologie.
Insuffisance hépatique
En cas d'insuffisance hépatique légère à modérée, OLODATÉROL peut être utilisé sans adaptation de la posologie.
Il n'existe pas de données concernant l'administration de OLODATÉROL chez les patients atteints d'insuffisance hépatique sévère.
Insuffisance rénale
En cas d'insuffisance rénale, OLODATÉROL peut être utilisé sans adaptation de la posologie. Les données relatives à l'utilisation de OLODATÉROL chez les patients atteints d'insuffisance rénale sévère sont limitées.
Population pédiatrique
Il n'y a pas de justification à l'utilisation de OLODATÉROL dans la population pédiatrique (moins de 18 ans).
Mode d'administration
Pour une administration correcte du médicament, le médecin ou un autre professionnel de santé devra s'assurer du bon usage de l'appareil par le patient.
Mode d'emploi
Introduction
OLODATÉROL (olodatérol). Veuillez lire ce mode d'emploi avant d'utiliser OLODATÉROL.
Vous n'aurez besoin d'utiliser cet inhalateur qu'UNE SEULE FOIS PAR JOUR. À chaque fois que vous l'utilisez, prenez DEUX PRESSIONS (BOUFFEES).
Si OLODATÉROL n'a pas été utilisé pendant plus de 7 jours, libérez une pression (bouffée) vers le sol.
Si OLODATÉROL n'a pas été utilisé pendant plus de 21 jours, répétez les étapes 4 à 6 « Préparation pour la première utilisation » jusqu'à ce qu'un nuage soit visible. Puis, répétez les étapes 4 à 6 trois autres fois.
Ne touchez pas l'élément de perçage à l'intérieur de la base.
Comment entretenir votre OLODATÉROL
Nettoyer l'embout buccal, y compris la partie métallique à l'intérieur de l'embout buccal, avec un linge ou un tissu humide uniquement, au moins une fois par semaine.
Une décoloration mineure de l'embout buccal n'affecte pas les performances de votre inhalateur OLODATÉROL.
Si nécessaire, essuyer l'extérieur de votre inhalateur OLODATÉROL avec un linge humide.
Quand se procurer un nouvel inhalateur OLODATÉROL
Votre inhalateur OLODATÉROL contient 60 pressions (bouffées) (30 jours de traitement) s'il est utilisé comme indiqué (2 pressions (bouffées)/une fois par jour).
L'indicateur de dose montre approximativement la quantité de médicament restant dans l'inhalateur.
Lorsque l'indicateur de dose entre dans la zone rouge de l'échelle, vous devez renouveler votre prescription; il reste suffisamment de médicament pour environ 7 jours de traitement (14 pressions (bouffées)).
Lorsque l'indicateur de doses atteint la fin de l'échelle rouge, votre OLODATÉROL se bloque automatiquement aucune autre dose ne peut être libérée. A ce stade, la base transparente ne peut plus être tournée.
OLODATÉROL doit être jeté trois mois après l'avoir préparé pour sa première utilisation, même s'il n'a pas été complètement utilisé ou pas utilisé du tout.
Préparation pour la première utilisation
1. Retirez la base transparente Maintenez le capuchon fermé. Appuyez sur le cliquet de sécurité tout en retirant fermement la base transparente avec votre autre main. |
|
2. Insérez la cartouche Insérez l'extrémité la plus étroite de la cartouche dans l'inhalateur. Placez l'inhalateur sur une surface solide et poussez fermement jusqu'à ce qu'il se mette en place. Ne retirez pas la cartouche une fois qu'elle a été insérée dans l'inhalateur. |
|
3. Replacez la base transparente Remettez en place la base transparente jusqu'à entendre un déclic. Ne retirez plus la base transparente. |
|
4. Tournez Maintenez le capuchon fermé. Tournez la base transparente dans la direction des flèches imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour). |
|
5. Ouvrez Ouvrez le capuchon jusqu'à ce qu'il s'ouvre complètement. |
|
6. Pressez Dirigez l'inhalateur en direction du sol. Pressez le bouton de libération de la dose. Fermez le capuchon. Répétez les étapes 4 à 6 jusqu'à ce qu'un nuage soit visible. A l'apparition du nuage, répétez les étapes 4 à 6 trois autres fois. Votre inhalateur est maintenant prêt à être utilisé. Ces étapes n'impacteront pas le nombre de doses disponibles. Une fois préparé votre inhalateur pourra délivrer 60 pressions (bouffées) (30 doses). | |
Utilisation quotidienne
TOURNEZ Maintenez le capuchon fermé. TOURNEZ la base transparente dans la direction des flèches imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour). |
|
OUVREZ OUVREZ le capuchon jusqu'à ce qu'il s'ouvre complètement. |
|
PRESSEZ Expirez lentement et complètement. Fermez vos lèvres autour de l'embout buccal sans recouvrir les prises d'air. Dirigez votre inhalateur vers le fond de votre gorge. Tout en inspirant lentement et profondément par la bouche, PRESSEZ le bouton de libération de la dose et continuez d'inspirer lentement aussi longtemps que vous le pouvez sans être gêné. Maintenez votre respiration pendant 10 secondes ou aussi longtemps que vous le pouvez sans être gêné. Répétez TOURNEZ, OUVREZ, PRESSEZ pour un total de 2 bouffées. Fermez le capuchon jusqu'à la prochaine utilisation de votre inhalateur. |
|
Indications
Indications - OLODATÉROL - voie inhalée
OLODATÉROL est indiqué en traitement bronchodilatateur continu de la bronchopneumopathie chronique obstructive (BPCO).
Contre-indications
OLODATÉROL est contre-indiqué chez les patients présentant une hypersensibilité à l'olodatérol ou à l'un des excipients .
Effets indésirables
Effets indésirables - OLODATÉROL - voie inhalée
a. Résumé du profil de sécurité
Les réactions indésirables le plus fréquemment rapportées à la dose recommandée ont été : rhinopharyngite, sensations vertigineuses, hypertension, éruption cutanée et arthralgie. Ces réactions ont été en général d'intensité légère ou modérée.
b. Tableau résumé des effets indésirables
Les fréquences des effets indésirables présentées ci-dessous sont basées sur l'incidence des effets indésirables (c'est-à-dire les événements imputables à l'olodatérol) observés dans le groupe olodatérol 5 mcg (1 035 patients), regroupés à partir de 6 études cliniques conduites en groupes parallèles contrôlées contre placebo, incluant des patients présentant une BPCO, dont les durées de traitement étaient comprises entre 4 et 48 semaines.
La fréquence est définie selon la classification conventionnelle :
Très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1000 à <1/100) ; rare (≥1/10 000 à <1/1000) ; très rare (<1/10 000) ; non déterminé (fréquence ne pouvant être estimée sur la base des données disponibles).
Classe d'organes / Terme MedDRA recommandé | Fréquence |
Infections et infestations |
|
Rhinopharyngite | Peu fréquent |
| |
Troubles du système nerveux |
|
Sensations vertigineuses | Peu fréquent |
| |
Troubles vasculaires |
|
Hypertension | Rare |
| |
Troubles cutanés et du tissu sous-cutané |
|
Eruption cutanée | Peu fréquent |
| |
Troubles musculo-squelettiques et systémiques |
|
Arthralgie | Rare |
c. Description d'effets indésirables sélectionnés
La survenue d'une éruption cutanée peut être considérée comme une réaction d'hypersensibilité à OLODATÉROL. Comme avec tous les médicaments absorbés par voie topique, d'autres types de réactions d'hypersensibilité peuvent survenir.
d. Profil d'effets indésirables des agonistes bêta2-adrénergiques
OLODATÉROL appartient à la classe thérapeutique des agonistes β2-adrénergiques de longue durée d'action. De ce fait, l'apparition d'effets indésirables liés à la classe des agonistes β2-adrénergiques doit être prise en compte, par exemple tachycardie, arythmie, palpitations, ischémie myocardique, angine de poitrine, hypertension ou hypotension, tremblement, céphalées, nervosité, insomnie, sensations vertigineuses, sécheresse buccale, nausées, spasmes musculaires, fatigue, malaise, hypokaliémie, hyperglycémie et acidose métabolique.
Surdosage
Symptômes
Un surdosage en olodatérol peut entraîner une exacerbation des effets spécifiques des agonistes β2‑adrénergiques, tels que : ischémie myocardique, hypertension ou hypotension, tachycardie, arythmies, palpitations, sensations vertigineuses, nervosité, insomnies, anxiété, céphalées, tremblements, sécheresse buccale, spasmes musculaires, nausées, fatigue, malaise, hypokaliémie, hyperglycémie et acidose métabolique.
Conduite à tenir en cas de surdosage
Le traitement par OLODATÉROL doit être arrêté. Un traitement symptomatique et une surveillance sont indiqués. En cas de signes de gravité, les patients doivent être hospitalisés. L'utilisation de bêta-bloquants cardiosélectifs peut être envisagée, mais avec une extrême prudence car l'administration d'un bêta-bloquant peut favoriser le bronchospasme.
Grossesse/Allaitement
Grossesse
Il n'existe pas de données concernant l'utilisation de OLODATÉROL chez la femme enceinte. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction à des niveaux d'exposition systémiques similaires à ceux observés aux doses thérapeutiques .
Par précaution, il est préférable d'éviter l'utilisation de OLODATÉROL pendant la grossesse.
Comme les autres agonistes β2-adrénergiques, l'olodatérol peut inhiber le travail au moment de l'accouchement par effet relaxant sur le muscle lisse utérin.
Allaitement
Aucune donnée clinique n'est disponible concernant des femmes exposées à l'olodatérol pendant l'allaitement.
Le passage de l'olodatérol et de ses métabolites dans le lait maternel n'est pas connu. Les données de pharmacocinétique/toxicologie disponibles chez les animaux ont mis en évidence l'excrétion de l'olodatérol et/ou de ses métabolites dans le lait.
Administré à la dose de 5 mcg par jour, l'exposition systémique à l'olodatérol et à ses métabolites est négligeable chez la femme qui allaite. Par conséquent, aucun effet significatif n'est attendu chez le nouveau-né/nourrisson allaité.
La décision d'interrompre l'allaitement ou bien le traitement avec OLODATÉROL doit prendre en compte le bénéfice de l'allaitement pour l'enfant par rapport au bénéfice du traitement pour la femme.
Fertilité
Aucune donnée clinique sur la fertilité n'est disponible pour OLODATÉROL. Les études précliniques réalisées avec l'olodatérol n'ont pas montré d'effet indésirable sur la fertilité.
Interactions avec d'autres médicaments
Médicaments adrénergiques
L'administration concomitante d'autres médicaments adrénergiques (seuls ou dans le cadre d'un traitement en association) peut potentialiser les effets indésirables de OLODATÉROL.
Dérivés xanthiques, stéroïdes ou diurétiques
Un traitement concomitant par des dérivés xanthiques, des stéroïdes ou des diurétiques non épargneurs du potassium est susceptible de potentialiser les effets hypokaliémiants des agonistes adrénergiques .
Bêta-bloquants
Les bêta-bloquants peuvent diminuer ou antagoniser l'effet de OLODATÉROL. OLODATÉROL ne doit donc pas être administré avec des bêta-bloquants (y compris en collyres) sauf nécessité absolue. Dans ce cas, l'utilisation de bêta-bloquants cardiosélectifs pourra être envisagée mais avec prudence.
Inhibiteurs de la monoamine oxydase (IMAO) et antidépresseurs tricycliques, médicaments qui prolongent l'intervalle QTc
Les inhibiteurs de la monoamine oxydase ou les antidépresseurs tricycliques, ou d'autres médicaments connus pour prolonger l'intervalle QTc, peuvent potentialiser l'action de OLODATÉROL sur le système cardio-vasculaire.
Interactions pharmacocinétiques
Il n'a pas été observé d'effet significatif sur l'exposition systémique à l'olodatérol dans les études d'interaction pharmacocinétique étudiant l'effet de l'administration concomitante de fluconazole, utilisé comme modèle d'inhibiteur du CYP 2C9.
L'administration concomitante du kétoconazole qui est un inhibiteur puissant de la P‑gp et du cytochrome P (CYP), a augmenté l'exposition systémique à l'olodatérol d'environ 70%. Il n'y a pas lieu d'envisager une adaptation de la dose.
L'administration concomitante de l'olodatérol avec le tiotropium n'a pas entrainé d'effet significatif sur l'exposition systémique des deux médicaments.
Les études conduites in vitro n'ont pas mis en évidence d'effet inhibiteur de l'olodatérol sur les enzymes du CYP ni sur les transporteurs des médicaments aux concentrations plasmatiques atteintes en pratique clinique.

 Français
Français Русский
Русский