Pharmacodynamique
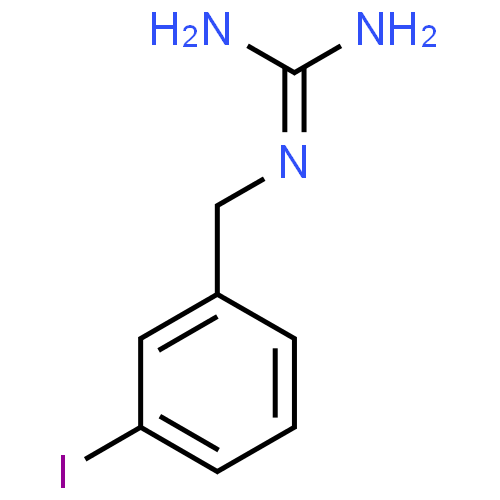
L'iobenguane (123I) est une aralkylguanidine radioiodée. Elle est constituée d'un groupe guanidine de la guanéthidine, lié à un radical benzyle dans lequel l'iode a été introduit. Comme la guanéthidine, les alkylguanidines sont des agents adrénergiques neuro-bloquants. En raison d'une ressemblance fonctionnelle entre les neurones adrénergiques et les cellules chromaffines de la partie médullaire des glandes surrénales, l'iobenguane se fixe de façon préférentielle sur ces structures. Elle peut également se localiser dans le myocarde.
Parmi toutes les aralkylguanidines, l'iobenguane est préférée pour sa plus faible captation hépatique et sa meilleure stabilité in vivo, et donc une moindre captation thyroïdienne de l'iode libéré. Le transport de l'iobenguane au travers des membranes cellulaires de cellules dérivées de la crête neurale, est un processus actif, lorsque la concentration du produit est basse (cas des examens diagnostiques). Le mécanisme de captation peut-être inhibé par la prise d'inhibiteurs tels que la cocaïne ou la desméthylimipramine.
Après captation, un mécanisme de transfert actif concentre l'iobenguane intracellulaire vers les granules de stockage.
Pharmacocinétique
Pharmacocinétique - IOBENGUANE - usage parentéral
La captation initiale est importante dans le foie (33 % de la dose administrée) et bien moindre dans les poumons (3 %), le myocarde (0,8 %), la rate (0,6 %) et les glandes salivaires (0,4 %). La captation dans les glandes surrénales normales (médullosurrénale) est si faible qu'elle ne peut être visualisée au moyen de l'iobenguane (123I). Les surrénales hyperplasiques par contre ont une captation élevée.
L'iobenguane est en grande partie éliminée telle quelle par les reins. 70 à 90 % des doses administrées sont éliminées dans les urines dans les 4 premiers jours. Les métabolites suivants peuvent être retrouvés dans les urines: iode-123, acide (123I)-métaiodohippurique, (123I)-hydroxy-iodobenzylguanidine et acide (123I)-méta-iodobenzoïque. L'ensemble de ces substances représente environ 5 à 15% de la dose administrée.
Dosage
Dosage - IOBENGUANE - usage parentéral
Solution et solution et solution injectable
Le contenu des ampoules pris séparément ne doit pas être administré directement au patient.
L'iobenguane (123I) sera administrée par injection intraveineuse lente ou par perfusion. Si nécessaire, le volume administré peut être augmenté par dilution.
Chez l'enfant, la solution injectable d'iobenguane (123I) sera administrée aux doses suivantes:
Enfant de moins de 6 mois: 4 MBq par kg de poids (max. 40 MBq).
Enfant de 6 mois à 2 ans: 4 MBq par kg de poids (min. 40 MBq).
Enfant de plus de 2 ans: l'activité à injecter est une fraction de celle utilisée chez l'adulte calculée en fonction du poids. Les activités recommandées sont les suivantes:
| Poids en kg | Activité en MBq | Poids en kg | Activité en MBq | Poids en kg | Activité en MBq |
8 | 46 | 25 | 110 | 40 | 152 |
10 | 54 | 30 | 124 | 45 | 162 |
15 | 76 | 35 | 140 | 50 | 176 |
20 | 92 | | | | |
Chez l'adulte, l'activité recommandée est de 200 MBq mais des activités plus élevées peuvent s'avérer nécessaires.
Chez la personne âgée: il n'y a pas lieu d'adapter la dose.
Les scintigraphies du corps entier, antérieures ou postérieures, et/ou des images centrées sur les organes cibles, et/ou des images SPECT peuvent être réalisées 24 heures après l'administration de l'iobenguane (123I) et éventuellement répétées à 48 heures.
Indications
Indications - IOBENGUANE - usage systémique
Ce médicament est à usage diagnostique uniquement.
Après marquage avec une solution d'iodure (123I) de sodium:
Scintigraphie des tumeurs des tissus dérivés de la crête neurale embryonnaire, telles que les phéochromocytomes, les paragangliomes, les chémodectomes et les neurogangliomes.
Détection, classification et suivi après traitement des neuroblastomes.
Evaluation de la captation de l'iobenguane lorsqu'une utilisation thérapeutique est envisagée.
Recherche d'une hyperplasie médullosurrénalienne.
Appréciation de l'innervation sympathique du myocarde.
Contre-indications
Aucune contre-indication absolue connue à ce jour.
Effets indésirables
Effets indésirables - IOBENGUANE - usage systémique
Dans quelques rares cas, des effets secondaires peuvent être observés: rougeur, urticaire, nausées, frissons et autres symptômes de réactions anaphylactiques.
Si le produit est administré trop rapidement, on peut observer des palpitations, une dyspnée, des bouffées de chaleur, une hypertension transitoire et des crampes abdominales, pendant ou immédiatement après l'injection. Ces symptômes disparaissent dans l'heure qui suit leur apparition.
Pour tous les patients, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice diagnostique attendu. L'activité administrée doit être telle que l'irradiation qui en découle soit aussi faible que possible, en gardant à l'esprit la nécessité d'obtenir le diagnostic requis.
L'exposition aux radiations ionisantes peut potentiellement induire des cancers ou développer des déficiences héréditaires. L'expérience montre que, pour ce qui est des examens diagnostiques en médecine nucléaire, la fréquence de ces effets indésirables est très faible en raison des faibles activités utilisées.
Pour la plupart des examens de médecine nucléaire à des fins de diagnostic, la dose de radiations délivrée (Dose Efficace) est inférieure à 20 mSv. L'utilisation de plus fortes activités justifiés par le contexte clinique peuvent faire dépasser ce seuil.
Surdosage
Un surdosage est potentiellement impossible. Cependant, un surdosage en iobenguane entraîne la libération d'adrénaline. Cet effet de courte durée exige la mise en route d'un traitement destiné à faire baisser la tension artérielle tel que l'injection rapide d'un agent bloquant alpha-adrénergique à action rapide (phentolamine) suivie de l'administration d'un béta-bloquant (propranolol). Le rein étant l'organe principal d'élimination, l'élimination du radionucléide peut être augmentée par une diurèse forcée avec mictions fréquentes.
Grossesse/Allaitement
Grossesse
Lorsqu'il est nécessaire d'administrer un produit radiopharmaceutique à une femme en âge de procréer, toute éventualité de grossesse doit être écartée. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. Dans le doute, il est important que l'exposition aux radiations soit réduite au minimum pour obtenir les informations cliniques souhaitées. D'autres techniques n'impliquant pas l'emploi de radiations ionisantes peuvent être envisagées, si elles n'altèrent pas la qualité du diagnostic.
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du ftus. Il ne faut réaliser au cours de la grossesse que les seules investigations absolument nécessaires lorsque le bénéfice probable dépasse les risques encourus par la mère et le ftus.
Allaitement
Avant d'administrer un produit radiopharmaceutique à une femme en cours d'allaitement, il faut envisager de repousser l'examen jusqu'à la fin de l'allaitement ou s'assurer dans le cas contraire que le radiopharmaceutique choisi, est le plus approprié, compte-tenu de l'éventuel passage de la radioactivité dans le lait.
Si l'administration d'iobenguane (123I) est indispensable, l'allaitement doit être suspendu pendant au moins trois jours et le lait produit pendant cette période doit être éliminé.
L'allaitement peut être repris lorsque l'activité dans le lait ne risque pas d'entraîner une dose de radiations pour l'enfant supérieure à 1 mSv.
Interactions avec d'autres médicaments
Les médicaments suivants sont susceptibles de prolonger ou réduire la captation de l'iobenguane par les tumeurs des tissus dérivés de la crête neurale.
La nifédipine (inhibiteur calcique) prolonge la rétention de l'iobenguane.
Une captation réduite est observée lors de l'administration thérapeutique des produits suivants: réserpine, labetalol, les inhibiteurs calciques (diltiazem, nifédipine, vérapamil), les anti-dépresseurs tricycliques (amitriptyline, imipramine et leurs dérivés), les agents sympathomimétiques (présents dans les décongestionnants nasaux, tels que phényléphrine, éphédrine ou phénylpropranolamine), la cocaïne, les phénothiazines.
L'administration des ces médicaments doit être interrompue (habituellement quatre périodes biologiques) avant l'administration de l'iobenguane (123I).

 Français
Français Русский
Русский