Pharmacodynamique
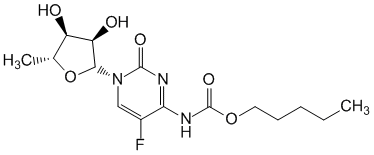
La capécitabine est un carbamate de la fluoropyrimidine non cytotoxique et se comporte comme un précurseur administré par voie orale de la fraction cytotoxique, le 5-fluorouracile (5-FU). L'activation de la capécitabine suit plusieurs étapes enzymatiques . L'enzyme impliquée dans la conversion finale en 5-FU, la thymidine phosphorylase (ThyPase) est localisée dans les tissus tumoraux, mais également dans les tissus sains habituellement à des taux moindres. Dans des modèles de xénogreffe de cancer humain, la capécitabine a fait preuve d'un effet synergique en association avec le docétaxel, effet qui serait lié à la régulation positive de la thymidine phosphorylase par le docétaxel.
Il semble que le métabolisme du 5-FU bloque dans la voie anabolique la méthylation de l'acide désoxyuridylique en acide thymidylique, ce qui perturbe la synthèse de l'acide désoxyribonucléique (ADN). L'incorporation du 5-FU entraîne également une inhibition de la synthèse de l'ARN et des protéines. Comme l'ADN et l'ARN sont indispensables à la division et à la croissance cellulaire, il est possible que le 5-FU agisse en générant une carence en thymidine qui provoque des déséquilibres de croissance et la mort cellulaire. Les effets de la carence en ADN et en ARN sont plus intenses au niveau des cellules qui prolifèrent plus rapidement et qui métabolisent plus vite le 5-FU.
Pharmacocinétique
Pharmacocinétique - CAPÉCITABINE - voie orale
Les paramètres pharmacocinétiques de la capécitabine ont été évalués dans l'intervalle posologique compris entre 502 et 3514 mg/m²/jour. Les paramètres de la capécitabine, des 5'-désoxy-5-fluorocytidine (5'-DFCR) et 5'-désoxy-5-fluorouridine (5'-DFUR) mesurés aux jours 1 et 14 étaient identiques. Au jour 14, l'ASC du 5-FU était augmentée de 30 à 35 %. La diminution de l'exposition systémique au 5-FU n'est pas proportionnelle à la diminution de la dose de capécitabine, elle est plus importante en raison de la pharmacocinétique non linéaire du métabolite actif.
Absorption
Après administration orale, la capécitabine est rapidement et largement absorbée, puis transformée de façon importante en ses métabolites : 5'-DFCR et 5'-DFUR. L'administration avec des aliments diminue le taux d'absorption de la capécitabine, mais n'a que peu d'effet sur l'ASC du 5' DFUR et l'ASC du métabolite ultérieur, le 5-FU. A J14, à la dose de 1250 mg/m², le produit étant administré après un repas, les pics de concentration plasmatique (Cmax en μg/ml) de la capécitabine, des 5'-DFCR, 5'-DFUR, 5-FU et FBAL étaient respectivement de 4,67 ; 3,05 ; 12,1 ; 0,95 et 5,46. Le délai d'obtention des pics de concentration plasmatique (Tmax en heures) était respectivement de 1,50 ; 2 ; 2 ; 2 et 3,34. Les valeurs de l'ASC0-∞ en μg.h/ml étaient respectivement de 7,75 ; 7,24 ; 24,6 ; 2,03 et 36,3.
Distribution
Les études in vitro avec du plasma humain ont montré que la capécitabine, les 5'-DFCR, 5'-DFUR et 5-FU sont liés aux protéines, principalement à l'albumine, respectivement à 54 %, 10 %, 62 % et 10 %.
Biotransformation
La capécitabine est d'abord métabolisée par la carboxylestérase hépatique en 5'-DFCR qui est ensuite converti en 5'-DFUR par la cytidine désaminase, principalement localisée dans le foie et les tissus tumoraux. L'activation catalytique du 5'-DFUR se déroule ensuite sous l'action de la thymidine phosphorylase (ThyPase). Les enzymes impliquées dans l'activation catalytique se trouvent dans les tissus tumoraux, mais aussi dans les tissus sains, bien qu'habituellement à des taux moindres. La biotransformation enzymatique séquentielle de la capécitabine en 5-FU conduit à des concentrations plus élevées dans les cellules tumorales. Dans le cas des tumeurs colorectales, la formation du 5-FU apparaît localisée en grande partie dans le stroma des cellules tumorales. Après l'administration orale de capécitabine à des patients présentant un cancer colorectal, le ratio de la concentration du 5-FU dans les tumeurs colorectales par rapport à la concentration dans les tissus voisins était de 3,2 (valeurs extrêmes 0,9 à 8,0). Le ratio tumeur/plasma de la concentration du 5-FU était de 21,4 (valeurs extrêmes 3,9 à 59,9 ; n = 8), alors que le ratio tissus sains/plasma était de 8,9 (valeurs extrêmes 3,0 à 25,8 ; n = 8). L'activité thymidine phosphorylase mesurée était 4 fois plus élevée dans la tumeur colorectale primitive que dans le tissu sain voisin. Selon les études immuno-histochimiques, la thymidine phosphorylase apparaît localisée en grande partie dans le stroma des cellules tumorales.
Le 5-FU est ensuite catabolisé par l'enzyme dihydropyrimidine déshydrogénase (DPD) en dihydro-5 fluorouracile (FUH2) beaucoup moins toxique. La dihydropyrimidinase clive le noyau pyrimidine pour donner l'acide 5-fluorouréidopropionique (FUPA). Finalement la β-uréidopropionase clive le FUPA en α-fluoro-β-alanine (FBAL) qui est éliminé dans l'urine. L'activité de la dihydropyrimidine déshydrogénase (DPD) constitue l'étape limitante. Un déficit en DPD peut conduire à une augmentation de la toxicité de la capécitabine .
Elimination
Les demi-vies d'élimination (t1/2 en heures) de la capécitabine, des 5'-DFCR, 5'-DFUR, 5-FU et FBAL étaient respectivement de 0,85 ; 1,11 ; 0,66 ; 0,76 et 3,23. La capécitabine et ses métabolites sont excrétés essentiellement dans les urines ; 95,5 % de la dose administrée de capécitabine ont été retrouvés dans les urines. L'excrétion fécale est minimale (2,6 %). Le métabolite principal éliminé dans les urines est le FBAL qui représente 57 % de la dose administrée. Environ 3 % de la dose administrée sont excrétés sous forme inchangée dans les urines.
Traitement associé
Des études de phase I évaluant l'effet de la capécitabine sur la pharmacocinétique du docétaxel ou du paclitaxel et réciproquement, n'ont démontré aucun effet de la capécitabine sur la pharmacocinétique du docétaxel ou du paclitaxel (Cmax et ASC) ni d'effet du docétaxel ou du paclitaxel sur la pharmacocinétique du 5'DFUR.
Pharmacocinétique chez des populations particulières
Une analyse de la pharmacocinétique de la population a été réalisée chez 505 patients présentant un cancer colorectal après l'administration de capécitabine à la posologie de 1250 mg/m² deux fois par jour. Sexe, présence ou absence de métastases hépatiques avant traitement, score de Karnofsky, bilirubine totale, sérum-albumine, ASAT ou ALAT, n'ont eu aucun effet statistiquement significatif sur la pharmacocinétique du 5'-DFUR, du 5-FU et du FBAL.
Patients présentant une insuffisance hépatique due à des métastases hépatiques : d'après les résultats d'une étude pharmacocinétique chez des patients cancéreux présentant une insuffisance hépatique légère à modérée à la suite de métastases hépatiques, la biodisponibilité de la capécitabine et l'exposition au 5-FU peuvent être augmentées en comparaison aux patients dont la fonction hépatique est normale. On ne dispose d'aucune donnée pharmacocinétique sur les patients présentant une insuffisance hépatique sévère.
Patients présentant une insuffisance rénale : d'après les résultats d'une étude pharmacocinétique chez des patients cancéreux présentant une insuffisance rénale modérée à sévère, la clairance de la créatinine n'a aucune influence évidente sur la pharmacocinétique du produit intact et du 5-FU. La clairance à la créatinine a une influence sur l'exposition systémique au 5'-DFUR (35 % d'augmentation dans l'ASC lorsque la clairance à la créatinine diminue de 50 %) et du FBAL (114 % d'augmentation dans l'ASC lorsque la clairance à la créatinine diminue de 50 %). FBAL est un métabolite sans activité anti-proliférative.
Patients âgés : d'après les résultats de l'analyse pharmacocinétique d'une population avec une large fourchette d'âges (27 à 86 ans) et incluant 234 patients âgés de 65 ans au moins (46 %), l'âge n'a eu aucune influence sur la pharmacocinétique du 5'-DFUR et du 5-FU. L'ASC du FBAL a augmenté avec l'âge (une augmentation de 20 % de l'âge entraîne une augmentation de 15 % de l'ASC du FBAL). Cette augmentation est probablement due à une modification de la fonction rénale.
Facteurs ethniques : suite à l'administration orale de 825 mg/m² de capécitabine deux fois par jour pendant 14 jours, les patients japonais (n = 18) ont eu une diminution de la Cmax d'environ 36 % et une diminution de l'ASC de 24 % de la capécitabine par rapport aux patients caucasiens (n = 22). Les patients japonais ont également eu une diminution de la Cmax d'environ 25 % et une diminution de l'ASC de 34 % pour le FBAL par rapport aux patients caucasiens. La pertinence clinique de ces différences est inconnue. Aucune différence significative dans l'exposition aux autres métabolites (5' DFCR, 5'-DFUR et 5-FU) n'est intervenue.
Dosage
Dosage - CAPÉCITABINE - voie orale
Comprimé pelliculé
La capécitabine doit seulement être prescrite par un médecin qualifié, expérimenté dans l'utilisation des anti-cancéreux. Une surveillance attentive est recommandée pour tous les patients pendant le premier cycle de traitement.
Le traitement doit être interrompu en cas de progression de la maladie ou d'observation d'une toxicité inacceptable. Pour le calcul des doses standard et réduites de capécitabine en fonction de la surface corporelle, pour des doses initiales de 1250 mg/m² et 1000 mg/m², se reporter respectivement aux tableaux 1 et 2.
Posologie
Posologie recommandée .
Monothérapie
Cancer du côlon, cancer colorectal et cancer du sein
En monothérapie, la posologie initiale recommandée de capécitabine dans le traitement du cancer du côlon en situation adjuvante, du cancer colorectal métastatique ou du cancer du sein localement avancé ou métastatique est de 1250 mg/m2 deux fois par jour (matin et soir ; soit une dose quotidienne totale de 2500 mg/m2) pendant 14 jours, suivie d'une période sans traitement de 7 jours. En traitement adjuvant, pour les patients ayant un cancer du côlon de stade III, il est recommandé de traiter pour une durée totale de 6 mois.
Association de traitements
Cancer du côlon, cancer colorectal et cancer gastrique
En association de traitements, la dose initiale recommandée de capécitabine doit être réduite à 800-1000 mg/m2 deux fois par jour pendant 14 jours, suivie d'une période sans traitement de 7 jours, ou à 625 mg/m2 deux fois par jour en administration continue . En cas d'association avec l'irinotécan, la dose initiale recommandée est de 800 mg/m² deux fois par jour pendant 14 jours, associée à l'irinotécan à 200 mg/m2 le Jour 1, suivie d'une période sans traitement de 7 jours. L'ajout du bévacizumab dans l'association n'a pas d'effet sur la dose initiale de capécitabine. Pour les patients qui reçoivent l'association capécitabine plus cisplatine, une prémédication destinée à maintenir une bonne hydratation ainsi qu'un antiémétique doivent être débutés avant l'administration du cisplatine (conformément au RCP du cisplatine). Pour les patients qui reçoivent l'association capécitabine plus oxaliplatine, une prémédication par un antiémétique est recommandée conformément au RCP de l'oxaliplatine. En traitement adjuvant du cancer du côlon de stade III, il est recommandé de traiter pour une durée de 6 mois.
Cancer du sein
En association avec le docétaxel, la dose initiale recommandée de capécitabine dans le traitement du cancer du sein métastatique est de 1250 mg/m2 deux fois par jour pendant 14 jours, suivie d'une période sans traitement de 7 jours, associée à 75 mg/m² de docétaxel, en perfusion intraveineuse d'une heure, toutes les 3 semaines. Pour les patients qui reçoivent l'association capécitabine plus docétaxel, une prémédication avec un corticostéroïde oral, tel que la dexaméthasone, doit être débutée avant l'administration de docétaxel (conformément au RCP de docétaxel).
Calcul de la dose de capécitabine
Tableau 1 Calcul de la dose standard et de la dose réduite de capécitabine en fonction de la surface corporelle : dose standard initiale de 1250 mg/m2
| Dose de 1250 mg/m2 (2 fois par jour) |
| Dose complète 1250 mg/m2 | Nombre de comprimés à 150 mg et/ou à 500 mg par prise (chaque prise ayant lieu le matin et le soir) | Réduction de dose (75 %) 950 mg/m2 | Réduction de dose (50 %) 625 mg/m2 |
Surface corporelle (m²) | Dose par administration (mg) | 150 mg | 500 mg | Dose par administration (mg) | Dose par administration (mg) |
≤ 1,26 | 1500 | - | 3 | 1150 | 800 |
1,27 - 1,38 | 1650 | 1 | 3 | 1300 | 800 |
1,39 - 1,52 | 1800 | 2 | 3 | 1450 | 950 |
1,53 - 1,66 | 2000 | - | 4 | 1500 | 1000 |
1,67 - 1,78 | 2150 | 1 | 4 | 1650 | 1000 |
1,79 - 1,92 | 2300 | 2 | 4 | 1800 | 1150 |
1,93 - 2,06 | 2500 | - | 5 | 1950 | 1300 |
2,07 - 2,18 | 2650 | 1 | 5 | 2000 | 1300 |
≥ 2,19 | 2800 | 2 | 5 | 2150 | 1450 |
Tableau 2 Calcul de la dose standard et de la dose réduite de capécitabine en fonction de la surface corporelle : dose standard initiale de 1000 mg/m2
| Dose de 1000 mg/m2 (2 fois par jour) |
| Dose complète 1000 mg/m2 | Nombre de comprimés à 150 mg et/ou à 500 mg par prise (chaque prise ayant lieu le matin et le soir) | Réduction de dose (75 %) 750 mg/m2 | Réduction de dose (50 %) 500 mg/m2 |
Surface corporelle (m²) | Dose par administration (mg) | 150 mg | 500 mg | Dose par administration (mg) | Dose par administration (mg) |
≤ 1,26 | 1150 | 1 | 2 | 800 | 600 |
1,27 - 1,38 | 1300 | 2 | 2 | 1000 | 600 |
1,39 - 1,52 | 1450 | 3 | 2 | 1100 | 750 |
1,53 - 1,66 | 1600 | 4 | 2 | 1200 | 800 |
1,67 - 1,78 | 1750 | 5 | 2 | 1300 | 800 |
1,79 - 1,92 | 1800 | 2 | 3 | 1400 | 900 |
1,93 - 2,06 | 2000 | - | 4 | 1500 | 1000 |
2,07 - 2,18 | 2150 | 1 | 4 | 1600 | 1050 |
≥ 2,19 | 2300 | 2 | 4 | 1750 | 1100 |
Ajustements posologiques durant le traitement :
Généralités
La toxicité due à l'administration de capécitabine peut être contrôlée par un traitement symptomatique et/ou par une modification de la posologie (interruption du traitement ou réduction de la dose). Une fois la dose réduite, celle-ci ne devra pas être augmentée ultérieurement. Pour les toxicités considérées par le médecin traitant comme ne pouvant probablement pas devenir graves ou menacer le pronostic vital, par exemple l'alopécie, l'altération du goût, les modifications unguéales, le traitement peut être poursuivi à la même dose, sans diminution ni interruption. Les patients sous traitement par capécitabine devront être informés de la nécessité d'interrompre immédiatement le traitement en cas de survenue d'une toxicité modérée ou sévère. Les doses de capécitabine non prises en raison de la toxicité ne sont pas remplacées. Les modifications posologiques recommandées en cas de toxicité figurent dans le tableau suivant :
Tableau 3 Schéma d'adaptation de dose de capécitabine (cycle de 3 semaines ou traitement continu)
Toxicité Grades* | Modification de la dose au cours d'un cycle de traitement | Ajustement posologique pour le cycle suivant/dose (% de la posologie initiale) |
Grade 1 | Maintenir la posologie | Maintenir la posologie |
Grade 2 | | |
- 1ère apparition | Interrompre le traitement jusqu'à retour au grade 0-1 | 100 % |
- 2e apparition | 75 % |
- 3e apparition | | 50 % |
- 4e apparition | Arrêter le traitement définitivement | Sans objet |
Grade 3 | | |
- 1ère apparition | Interrompre le traitement jusqu'à retour au grade 0-1 | 75 % |
- 2e apparition | 50 % |
- 3e apparition | Arrêter le traitement définitivement | Sans objet |
Grade 4 | | |
- 1ère apparition | Arrêter le traitement définitivement ou Si le médecin juge qu'il est souhaitable dans l'intérêt du patient de continuer, interrompre le traitement jusqu'à retour au grade 0-1 | 50 % |
- 2e apparition | Arrêter le traitement définitivement | Sans objet |
* Conformément aux critères de toxicité du NCIC CTG (National Cancer Institute of Canada Clinical Trial Group) (version 1) ou aux critères du CTEP (Cancer Therapy Evaluation Program) pour les CTCAE (Common Terminology Criteria for Adverse Events) du programme d'évaluation des traitements anticancéreux de l'US National Cancer Institute (version 4.0).
Hématologie
Les patients présentant une neutropénie < 1,5 x 109/L et/ou une thrombopénie < 100 x 109/L à l'instauration du traitement ne doivent pas être traités par capécitabine. Si des analyses biologiques, non programmées, effectuées au cours d'un cycle de traitement, révèlent une neutropénie inférieure à 1,0 x 109/L ou que le taux de plaquettes chute à une valeur inférieure à 75 x 109/L, le traitement par capécitabine doit être interrompu.
Modifications de la dose en cas de toxicité, lorsque la capécitabine est utilisée en association avec d'autres médicaments pendant des cycles de 3 semaines
Les modifications de la dose en cas de toxicité, lorsque la capécitabine est utilisée en association avec d'autres médicaments pendant des cycles de 3 semaines, devront être réalisées conformément aux recommandations données dans le tableau 3 ci-dessus pour capécitabine, et conformément au résumé des caractéristiques du (des) médicament(s) associé(s).
Au début d'un cycle, s'il est indiqué de reporter un traitement, qu'il s'agisse de capécitabine ou du (des) médicament (s) associé(s), alors l'administration de tous les médicaments devra être retardée jusqu'à ce que les conditions pour débuter tous les traitements soient remplies.
Pendant un cycle de traitement, pour les toxicités considérées par le médecin traitant comme non liées à la capécitabine, la capécitabine devra être poursuivie et la posologie du produit associé devra être ajustée conformément aux informations de prescription appropriées.
Si le ou les médicament(s) associé(s) doivent être arrêtés définitivement, le traitement par capécitabine peut être repris lorsque les conditions à la reprise du traitement par capécitabine sont remplies.
Cette recommandation s'applique à toutes les indications et à toutes les populations particulières.
Modifications de la dose en cas de toxicité, lorsque la capécitabine est utilisée en continu et en association
Les modifications de la dose en cas de toxicité, lorsque capécitabine est utilisée en continu en association, devront être réalisées conformément aux recommandations données dans le tableau 3 ci-dessus pour la capécitabine et conformément au résumé des caractéristiques du ou des médicament(s) associé(s).
Ajustements de posologie pour des populations particulières
Insuffisance hépatique
Les données d'efficacité et de tolérance disponibles concernant les patients présentant une insuffisance hépatique ne sont pas suffisantes pour permettre de donner des recommandations d'ajustements posologiques. Il n'existe pas de données disponibles sur l'insuffisance hépatique dû à une cirrhose ou une hépatite.
Insuffisance rénale
La capécitabine est contre-indiquée chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine avant traitement inférieure à 30 mL/min [Cockcroft et Gault]). Comparée à celle de la population globale, l'incidence des effets indésirables de grade 3 ou 4 chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine avant traitement comprise entre 30-50 mL/min) est augmentée. Chez les patients présentant une insuffisance rénale modérée avant traitement, il est recommandé de réduire la posologie à 75 % pour une dose initiale de 1250 mg/m2. Chez les patients présentant une insuffisance rénale modérée avant traitement, aucune réduction de posologie n'est recommandée pour une dose initiale de 1000 mg/m2. Chez les patients présentant une insuffisance rénale légère (clairance de la créatinine avant traitement comprise entre 51-80 mL/min), aucun ajustement posologique n'est recommandé. Une surveillance attentive et une rapide interruption du traitement sont conseillées lorsqu'un patient développe un effet indésirable de grade 2, 3 ou 4 pendant le traitement et après ajustement de la posologie comme indiqué dans le tableau 3 ci-dessus. Si la clairance de la créatinine calculée diminue pendant le traitement à une valeur inférieure à 30 mL/min, le traitement par capécitabine doit être interrompu. Ces recommandations d'adaptation de posologie pour l'insuffisance rénale concernent à la fois la monothérapie et l'association (voir aussi le paragraphe « Sujet âgé » ci-dessous).
Sujet âgé
En monothérapie par capécitabine, aucun ajustement de la posologie initiale n'est nécessaire. Cependant, les effets indésirables de grade 3 ou 4 liés au traitement ont été plus fréquemment observés chez les patients âgés de 60 ans ou plus comparés aux patients plus jeunes.
Lorsque la capécitabine a été associée à d'autres médicaments, les patients âgés (≥ 65 ans) ont présenté davantage d'effets indésirables de grades 3 et 4, y compris ceux pouvant mener à un arrêt du traitement, comparativement aux patients plus jeunes. Une surveillance attentive des patients âgés de 60 ans ou plus est recommandée.
En association avec le docétaxel : une augmentation de l'incidence des effets indésirables de grade 3 ou 4 liés au traitement et des effets indésirables graves liés au traitement a été observée chez des patients âgés de 60 ans ou plus . Pour les patients âgés de 60 ans ou plus, une réduction de la dose initiale de capécitabine à 75 % (950 mg/m2 deux fois par jour) est recommandée.
Si aucune toxicité n'est observée chez les patients âgés de 60 ans ou plus avec une posologie initiale réduite de capécitabine en association au docétaxel, la posologie de capécitabine peut être prudemment augmentée jusqu'à 1,250 mg/m2 deux fois par jour.
Population pédiatrique
Il n'y a pas d'utilisation pertinente de la capécitabine dans la population pédiatrique dans les indications du cancer du côlon, du cancer colorectal, du cancer gastrique et du cancer du sein.
Mode d'administration
Les comprimés de capécitabine doivent être pris avec de l'eau dans les 30 minutes suivant un repas.
Indications
Indications - CAPÉCITABINE - usage systémique
CAPÉCITABINE est indiqué :
en traitement adjuvant du cancer du côlon de stade III (Stade C de Dukes) après résection ;
dans le traitement du cancer colorectal métastatique ;
en première ligne, dans le traitement du cancer gastrique avancé, en association à une chimiothérapie à base de sel de platine ;
en association avec le docétaxel dans le traitement du cancer du sein localement avancé ou métastatique, après échec à une chimiothérapie cytotoxique. La chimiothérapie antérieure doit avoir comporté une anthracycline ;
en monothérapie dans le traitement du cancer du sein localement avancé ou métastatique, après échec aux taxanes et à une chimiothérapie contenant une anthracycline ou lorsqu'une chimiothérapie supplémentaire par anthracycline n'est pas indiquée.
Contre-indications
Antécédents de réactions sévères et inattendues à un traitement contenant une fluoropyrimidine.
Chez les patients présentant une absence complète d'activité de la dihydro-pyrimidine-déshydrogénase (DPD) .
Pendant la grossesse et l'allaitement.
Chez les patients ayant une leucopénie, neutropénie ou thrombopénie sévère.
Chez les insuffisants hépatiques sévères.
Chez les insuffisants rénaux sévères (clairance de la créatinine inférieure à 30 mL/min).
Traitement par la sorivudine ou ses analogues chimiquement apparentés, telle que la brivudine .
Si une contre-indication existe pour l'un des médicaments associés, quel qu'il soit, alors ce médicament ne doit pas être utilisé.
Effets indésirables
Effets indésirables - CAPÉCITABINE - usage systémique
Résumé du profil de tolérance
Le profil de tolérance global de la capécitabine est issu de données recueillies chez plus de 3 000 patients, traités par capécitabine en monothérapie, ou par capécitabine en association à différentes chimiothérapies dans différentes indications. Les profils de tolérance de capécitabine en monothérapie dans le cancer du sein métastatique, le cancer colorectal métastatique et le cancer du côlon en adjuvant sont comparables.
Les effets indésirables liés au traitement les plus fréquemment rapportés et/ou cliniquement pertinents étaient les affections gastro-intestinales (particulièrement diarrhées, nausées, vomissements, douleurs abdominales, stomatites), syndrome main-pied (érythrodysesthésie palmo-plantaire), fatigue, asthénie, anorexie, cardiotoxicité, augmentation des troubles rénaux chez les patients dont la fonction rénale est déjà altérée, et thrombose/embolie.
Résumé des effets indésirables sous forme de tableau
Les effets indésirables dont le lien de causalité avec l'administration de capécitabine a été considéré par les investigateurs comme possible, probable ou douteux, sont listés dans le tableau 4 lorsque la capécitabine est administrée en monothérapie et dans le tableau 5 lorsque la capécitabine est administrée en association à différentes chimiothérapies dans différentes indications. Les libellés suivants sont utilisés pour classer les effets indésirables par fréquence : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000) et très rare (< 1/10 000). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Capécitabine en monothérapie
Le tableau 4 liste les effets indésirables, associés à l'utilisation de capécitabine en monothérapie, d'après une analyse de l'ensemble des données de tolérance des trois principales études cliniques incluant plus de 1 900 patients (études M66001, SO14695 et SO14796). Les effets indésirables sont classés dans le groupe de fréquence approprié selon l'incidence globale provenant de l'analyse de l'ensemble des données.
Tableau 4 Résumé des effets indésirables notifiés chez les patients traités par capécitabine en monothérapie
Classe de systèmes d'organes | Très fréquent Tous grades | Fréquent Tous grades | Peu fréquent Sévère et/ou mettant en jeu le pronostic vital (grade 3-4) ou considéré comme médicalement significatif | Rare/Très rare (Expérience post-commercialisation) |
Infections et infestations | - | Infection par le virus de l'herpès Rhinopharyngite Infection des voies respiratoires basses | Sepsis Infection des voies urinaires Cellulite Amygdalite Pharyngite Candidose buccale Grippe Gastroentérite Infection fongique Infection Abcès dentaire | |
Tumeurs bénignes, malignes et non précisées | - | - | Lipome | |
Affections hématologiques et du système lymphatique | - | Neutropénie Anémie | Neutropénie fébrile Pancytopénie Granulopénie Thrombopénie Leucopénie Anémie hémolytique Augmentation de l'International Normalised Ratio (INR)/Temps de prothrombine prolongé | |
Affections du système immunitaire | - | - | Hypersensibilité | |
Troubles du métabolisme et de la nutrition | Anorexie | Déshydratation Perte de poids | Diabète Hypokaliémie Trouble de l'appétit Malnutrition Hypertriglycéridémie, | |
Affections psychiatriques | - | Insomnie Dépression | État confusionnel Attaque de panique Humeur dépressive Diminution de la libido | |
Affections du système nerveux | - | Céphalées Léthargie Vertiges Paresthésie Dysgueusie | Aphasie Troubles de la mémoire Ataxie Syncope Trouble de l'équilibre Trouble sensoriel Neuropathie périphérique | Leucoencéphalopathie toxique (très rare) |
Affections oculaires | - | Larmoiement Conjonctivite Irritation oculaire | Diminution de l'acuité visuelle Diplopie | Sténose du canal lacrymal (rare) Affections cornéennes (rare) Kératite (rare) Kératite ponctuée (rare) |
Affections de l'oreille et du labyrinthe | - | - | Vertige Douleur de l'oreille | |
Affections cardiaques | - | - | Angor instable Angine de poitrine Ischémie myocardique Fibrillation auriculaire Arythmie Tachycardie Tachycardie sinusale Palpitations | Fibrillation ventriculaire (rare) Allongement de l'intervalle QT (rare) Torsade de pointe (rare) Bradycardie (rare) Vasospasme (rare) |
Affections vasculaires | - | Thrombophlébite | Thrombose veineuse profonde Hypertension Pétéchies Hypotension Bouffées de chaleur Refroidissement des extrémités | |
Affections respiratoires, thoraciques et médiastinales | - | Dyspnée Épistaxis Toux Rhinorrhée | Embolie pulmonaire Pneumothorax Hémoptysie Asthme Dyspnée d'effort | |
Affections gastro-intestinales | Diarrhées Vomissements Nausées Stomatites Douleurs, abdominales | Hémorragie gastro-intestinale Constipation Douleur épigastrique Dyspepsie Flatulence Sécheresse de la bouche | Occlusion intestinale Ascite Entérite Gastrite Dysphagie Douleur abdominale basse sophagite Inconfort abdominal Reflux gastro-sophagien Colite Sang dans les selles | |
Affections hépatobiliaires | - | Hyperbilirubinémie Anomalies biologiques hépatiques | Jaunisse | Insuffisance hépatique (rare) Cholestase hépatique (rare) |
Affections de la peau et du tissu sous-cutané | Syndrome d'érythrodysesthésie palmo-plantaire** | Eruption Alopécie Erythème Sécheresse cutanée Prurit Hyperpigmentation cutanée Eruption maculaire Desquamation cutanée Dermatite Trouble de la pigmentation Atteinte unguéale | Cloque Ulcère cutané Eruption Urticaire Réaction de photosensibilité Erythème palmaire dème facial Purpura Syndrome radio-induit | Lupus érythémateux cutané (rare) Réactions cutanées sévères telles que syndrome de Stevens-Johnson et nécrolyse épidermique toxique (très rare) |
Affections musculo-squelettiques et systémiques | - | Douleur des extrémités Douleur dorsale Arthralgies | dème des articulations Douleur osseuse Douleur faciale Raideur musculo-squelettique Faiblesse musculaire | |
Affections du rein et des voies urinaires | - | - | Hydronéphrose Incontinence urinaire Hématurie Nycturie Augmentation de la créatinémie | |
Affections des organes de reproduction et du sein | - | - | Hémorragie vaginale | |
Troubles généraux et anomalies au site d'administration | Fatigue Asthénie | Épisode fébrile dème périphérique Malaise Douleur thoracique | dème Frissons Syndrome pseudo-grippal Tremblements Augmentation de la température corporelle | |
** À partir de l'expérience post-commercialisation, un syndrome d'érythrodysesthésie palmo-plantaire persistant ou sévère peut induire une perte des empreintes digitales .
Capécitabine en association de traitement :
Le tableau 5 liste les effets indésirables liés à l'utilisation de capécitabine associée à différentes chimiothérapies dans différentes indications, d'après les données de tolérance chez plus de 3 000 patients. Les effets indésirables sont classés par groupe de fréquence (très fréquent ou fréquent) selon l'incidence la plus élevée retrouvée dans chacune des principales études cliniques et ont été classés seulement s'il s'agit d'autres effets indésirables que ceux observés avec capécitabine en monothérapie ou dans un groupe de fréquence supérieure comparé à capécitabine en monothérapie (voir tableau 4). Les effets indésirables peu fréquents observés lors de l'association de capécitabine à un autre traitement sont comparables à ceux observés avec capécitabine en monothérapie ou à ceux du médicament associé utilisé en monothérapie (conformément aux données publiées et/ou aux résumés des caractéristiques des produits respectifs).
Certains de ces effets indésirables correspondent à ceux fréquemment observés avec un médicament associé (par exemple : neuropathie sensitive périphérique avec le docétaxel ou l'oxaliplatine, hypertension avec le bévacizumab) ; toutefois une exacerbation lors du traitement par capécitabine ne peut être exclue.
Tableau 5 Résumé des effets indésirables notifiés chez les patients traités par capécitabine en association de traitements, en addition de ceux déjà observés avec capécitabine en monothérapie ou à une fréquence supérieure comparé à la capécitabine en monothérapie.
Classe de systèmes d'organes | Très fréquent Tous grades | Fréquent Tous grades | Rare/Très rare (Expérience post-commercialisation) |
Infections et infestations | - | Zona Infection urinaire Candidose buccale Infection des voies respiratoires supérieures Rhinite Grippe +Infection Herpès buccal | |
Affections hématologiques et du système lymphatique | +Neutropénie +Leucopénie +Anémie +Fièvre neutropénique Thrombopénie | Aplasie médullaire +Neutropénie fébrile | |
Affections du système immunitaire | - | Hypersensibilité | |
Troubles du métabolisme et de la nutrition | Diminution de l'appétit | Hypokaliémie Hyponatrémie Hypomagnésémie Hypocalcémie Hyperglycémie | |
Affections psychiatriques | - | Trouble du sommeil Anxiété | |
Affections du système nerveux | Paresthésie Dysesthésie Neuropathies périphériques Neuropathies sensorielles périphériques Dysgueusie Céphalées | Neurotoxicité Tremblements Névralgies Réaction d'hypersensibilité Hypoesthésie | |
Affections oculaires | Larmoiements | Troubles visuels Sécheresse oculaire Douleur oculaire Diminution de l'acuité visuelle Vision floue | |
Affections de l'oreille et du labyrinthe | - | Acouphènes Hypoacousie | |
Affections cardiaques | - | Fibrillation auriculaire Ischémie cardiaque/Infarctus | |
Affections vasculaires | dème des membres inférieurs Hypertension +Embolie et thromboses | Bouffées vasomotrices Hypotension Poussée hypertensive Bouffées de chaleur Phlébite | |
Affections respiratoires, thoraciques et médiastinales | Angine Dysesthésie pharyngée | Hoquet Douleur pharyngo-laryngée Dysphonie | |
Affections gastro-intestinales | Constipation Dyspepsie | Hémorragie gastro-intestinale haute Ulcération buccale Gastrite Distension abdominale Reflux gastro-sophagien Douleur buccale Dysphagie Rectorragie Douleur abdominale basse Dysesthésie buccale Paresthésie buccale Hypoesthésie buccale Inconfort abdominal | |
Affections hépatobiliaires | - | Fonction hépatique anormale | |
Affections de la peau et du tissu sous-cutané | Alopécie Troubles unguéaux | Hyperhidrose Eruption érythémateuse Urticaire Sueurs nocturnes | |
Affections musculo-squelettiques et systémiques | Myalgie Arthralgie Douleur des extrémités | Douleur de la mâchoire Spasmes musculaires Trismus Faiblesse musculaire | |
Affections du rein et des voies urinaires | - | Hématurie Protéinurie Diminution de la clairance rénale de la créatinine Dysurie | Insuffisance rénale aiguë secondaire à une déshydratation (rare) |
Troubles généraux et anomalies au site d'administration | Pyrexie Faiblesse +Léthargie Intolérance à la fièvre | Inflammation des muqueuses Douleur des membres Douleur Frissons Douleur thoracique Syndrome pseudo-grippal +Fièvre Réaction liée à la perfusion Réaction au site d'injection Douleur au site de perfusion Douleur au site d'injection | |
Lésions, intoxications et complications liées aux procédures | - | Contusion | |
+ Pour chacun des termes, le niveau de fréquence est celui des effets indésirables de tous grades. Pour les termes marqués avec « + », le niveau de fréquence est celui des effets indésirables de grade 3-4. Les effets indésirables sont classés suivant la fréquence la plus élevée observée dans les principales études cliniques des traitements associés.
Description de certains effets indésirables
Syndrome main-pied
Lors de l'administration de 1250 mg/m² de capécitabine deux fois par jour pendant 14 jours toutes les 3 semaines, une fréquence de 53 à 60 % de syndrome main-pied de tous grades a été observée dans des études cliniques incluant la capécitabine en monothérapie (y compris les études dans le cancer du côlon en adjuvant, dans le cancer colorectal métastatique et dans le cancer du sein) et une fréquence de 63 % a été observée dans le groupe capécitabine plus docétaxel dans le traitement de cancer du sein métastatique. Lors de l'administration de 1000 mg/m² de capécitabine deux fois par jour pendant 14 jours toutes les 3 semaines, une fréquence de 22 à 30 % de syndrome main-pied de tous grades a été observée avec la capécitabine en association de traitements.
Une méta-analyse portant sur 14 études cliniques avec des données issues de plus de 4 700 patients traités soit par la capécitabine en monothérapie, soit par la capécitabine en association avec différentes chimiothérapies dans de multiples indications (cancer du côlon, colorectal, gastrique et du sein) a montré qu'un syndrome main-pied (tous grades) est survenu chez 2 066 patients (43 %) avec une durée moyenne de survenue de 239 jours [IC à 95 % 201, 288] après le début du traitement par la capécitabine. Dans toutes les études combinées, les facteurs suivants étaient associés de manière statistiquement significative à une augmentation du risque de développer un syndrome main-pied : augmentation de la dose initiale de capécitabine (gramme), diminution de la dose cumulative de capécitabine (0,1*kg), augmentation de l'intensité de la dose relative durant les six premières semaines, augmentation de la durée de traitement (semaines), augmentation de l'âge (par tranche de 10 ans), sexe féminin, et un bon score ECOG à l'état initial (0 versus ≥ 1).
Diarrhées
La capécitabine peut induire la survenue de diarrhées, observées chez plus de 50 % des patients traités.
Une méta-analyse portant sur 14 études cliniques avec des données issues de plus de 4 700 patients traités par la capécitabine ont montré que dans toutes les études combinées, les facteurs suivants étaient associés à une augmentation du risque de développer des diarrhées de manière statistiquement significative : augmentation de la dose initiale de capécitabine (gramme), augmentation de la durée de traitement (semaines), augmentation de l'âge (par tranche de 10 ans) et sexe féminin. Les facteurs suivants étaient associés de manière significative à une diminution du risque de survenue de diarrhée : augmentation de la dose cumulative de capécitabine (0,1*kg) et augmentation de l'intensité de la dose relative durant les 6 premières semaines.
Cardiotoxicité
En plus des effets indésirables décrits dans les tableaux 4 et 5, les effets indésirables suivants ont été rapportés avec une incidence de moins de 0,1 % associée à la capécitabine en monothérapie d'après une analyse de l'ensemble des données de tolérance issues de 7 études cliniques incluant 949 patients (2 études cliniques de phase III et 5 de phase II dans le cancer colorectal métastatique et le cancer du sein métastatique) : cardiomyopathie, insuffisance cardiaque, mort subite et extrasystoles ventriculaires.
Encéphalopathie
En plus des effets indésirables décrits dans les tableaux 4 et 5, et d'après les données de tolérance de l'analyse de l'ensemble des 7 études cliniques, l'encéphalopathie a également été associée à l'utilisation de capécitabine en monothérapie avec une incidence de moins de 0,1 %.
Populations particulières
Patients âgés
Une analyse des données de tolérance chez des patients âgés de 60 ans ou plus traités par capécitabine en monothérapie et une analyse des patients traités par l'association capécitabine plus docétaxel ont montré une augmentation de l'incidence des effets indésirables de grade 3 et 4 ainsi que des effets indésirables graves liés au traitement, par rapport aux patients de moins de 60 ans. Les patients de 60 ans ou plus traités par l'association capécitabine plus docétaxel ont également eu plus d'arrêts prématurés de traitements dus à des effets indésirables, par rapport aux patients âgés de moins de 60 ans.
Les résultats d'une méta-analyse portant sur 14 études cliniques avec des données issues de plus de 4 700 patients traités par la capécitabine ont montré que dans toutes les études combinées, l'augmentation de l'âge (par tranche de 10 ans) était associée de manière statistiquement significative à une augmentation du risque de développer un syndrome main-pied et des diarrhées et à une diminution du risque de développer une neutropénie.
Sexe
Les résultats d'une méta-analyse portant sur 14 études cliniques avec des données issues de plus de 4 700 patients traités par la capécitabine ont montré que dans toutes les études combinées, le sexe féminin était associé de manière statistiquement significative à une augmentation du risque de développer un syndrome main-pied et des diarrhées et à une diminution du risque de développer une neutropénie.
Insuffisants rénaux :
Une analyse de la tolérance chez les patients traités par capécitabine en monothérapie (cancer colorectal) présentant une insuffisance rénale avant traitement a montré une augmentation de l'incidence des effets indésirables de grade 3 et 4 liés au traitement comparé aux patients dont la fonction rénale était normale (respectivement 36 % chez les patients sans insuffisance rénale n = 268, versus 41 % chez les patients avec une insuffisance rénale légère n = 257 et 54 % lorsque l'insuffisance rénale était modérée n = 59) . Chez les patients présentant une insuffisance rénale modérée, il a été observé un taux plus élevé de réduction de la dose (44 %) versus 33 % chez les patients sans insuffisance rénale et 32 % chez les patients avec insuffisance rénale légère, ainsi qu'une augmentation des arrêts de traitement précoces (21 % d'arrêts de traitement pendant les deux premiers cycles) versus 5 % chez les patients sans insuffisance rénale et 8 % chez les patients avec insuffisance rénale légère.
Surdosage
Les manifestations du surdosage aigu sont les suivantes : nausées, vomissements, diarrhées, mucite, irritation et hémorragie gastro-intestinales et dépression médullaire osseuse. Le traitement médical du surdosage doit associer les mesures thérapeutiques et d'assistance habituellement prises pour corriger les troubles cliniques et prévenir leurs éventuelles complications.
Grossesse/Allaitement
Femmes en âge de procréer/Contraception chez l'homme et la femme
Il convient de recommander aux femmes en âge de procréer d'éviter toute grossesse au cours du traitement par la capécitabine. En cas de grossesse survenue au cours d'un traitement par la capécitabine, les risques potentiels pour le ftus doivent être expliqués. Une méthode de contraception efficace doit être utilisée pendant le traitement.
Grossesse
Il n'existe pas d'étude de la capécitabine utilisée chez la femme enceinte ; toutefois on peut supposer que la capécitabine administrée chez la femme enceinte pourrait entraîner des effets délétères chez le ftus. Lors d'études de la toxicité au cours de la reproduction chez l'animal, l'administration de capécitabine a provoqué une mortalité embryonnaire et des effets tératogènes. Ces effets observés sont attendus pour les dérivés de la fluoropyrimidine. La capécitabine est contre-indiquée au cours de la grossesse.
Allaitement
Le passage de capécitabine dans le lait maternel n'est pas connu. Des quantités importantes de capécitabine et de ses métabolites ont été retrouvées dans le lait de souris allaitantes. L'allaitement doit être interrompu en cas de traitement par capécitabine.
Fertilité
Il n'existe pas de données concernant l'impact de la capécitabine sur la fécondité. Les études pivotales de la capécitabine ont inclus des femmes en âge de procréer et des hommes sous réserve qu'ils aient accepté d'utiliser une méthode de contraception valide afin d'éviter toute grossesse pendant la durée de l'étude et pendant une durée appropriée après la fin de l'étude.
Des effets sur la fertilité ont été observés dans les études menées chez l'animal .
Interactions avec d'autres médicaments
Les études d'interaction n'ont été réalisées que chez l'adulte.
Interactions avec d'autres médicaments :
Substrats du cytochrome P-450 2C9
Excepté avec la warfarine, aucune étude formelle d'interaction entre la capécitabine et d'autres substrats du CYP2C9 n'a été menée. Des précautions doivent être prises lorsque la capécitabine est administrée de manière concomitante avec des substrats du 2C9 (par exemple, la phénytoïne).
Anticoagulants coumariniques
Des altérations des paramètres de la coagulation et/ou des saignements ont été rapportés chez des patients prenant de façon concomitante de la capécitabine et des anticoagulants dérivés de la coumarine, comme la warfarine et la phenprocoumone. Les effets sont survenus dans les jours voire les mois suivant le début du traitement par capécitabine et dans quelques cas dans le mois suivant l'arrêt du traitement. Dans une étude clinique d'interaction pharmacocinétique, après une dose unique de 20 mg de warfarine, un traitement par capécitabine a augmenté l'ASC de la S-warfarine de 57 % avec une augmentation de 91 % de la valeur de l'International Normalized Ratio (INR). Du fait que le métabolisme de la R-warfarine n'a pas été affecté, ces résultats indiquent que la capécitabine diminue la régulation de l'isoenzyme 2C9, mais n'a pas d'effet sur les isoenzymes 1A2 et 3A4. Les paramètres de la coagulation (TP ou INR) des patients prenant de façon concomitante de la capécitabine et des anticoagulants dérivés de la coumarine doivent être surveillés régulièrement et la dose d'anticoagulants ajustée en conséquence.
Phénytoïne
Une augmentation des concentrations plasmatiques de la phénytoïne entraînant des symptômes d'intoxication à la phénytoïne a été rapportée dans des cas isolés lors de l'administration concomitante de capécitabine et de phénytoïne. Un contrôle régulier des patients prenant de façon concomitante de la phénytoïne avec de la capécitabine doit être effectué afin de surveiller l'augmentation des concentrations plasmatiques de la phénytoïne.
Acide folinique/acide folique
Une étude de l'association capécitabine-acide folinique a montré que l'acide folinique n'exerce aucun effet important sur la pharmacocinétique de la capécitabine et de ses métabolites. L'acide folinique influe cependant sur la pharmacodynamie de la capécitabine, dont la toxicité peut être augmentée par l'acide folinique : la dose maximale tolérée (DMT) de capécitabine seule, en traitement intermittent, est de 3000 mg/m² par jour, alors qu'elle n'est que de 2000 mg/m² par jour, lorsqu'elle est associée avec l'acide folinique (30 mg x 2/jour par voie orale). L'augmentation de la toxicité doit être prise en considération lors du passage d'un traitement avec 5-FU/LV à un traitement avec la capécitabine. Cela doit également être pris en considération lors d'une supplémentation en acide folique en cas de carence en folate en raison de la similitude entre l'acide folinique et l'acide folique.
Sorivudine et apparentés
Une interaction médicamenteuse cliniquement significative entre la sorivudine et le 5-FU a été décrite. Elle résulte de l'inhibition de la dihydro-pyrimidine déshydrogénase par la sorivudine. Cette interaction qui peut entraîner l'augmentation de la toxicité fluoropyrimidinique est potentiellement fatale. En conséquence, la capécitabine ne doit pas être administrée en même temps que la sorivudine ou les substances chimiques analogues, telles que la brivudine . Un intervalle minimum de 4 semaines doit être observé entre la fin du traitement par la sorivudine ou substances chimiques analogues, telles que la brivudine, et le début du traitement par capécitabine.
Antiacides
L'effet d'un antiacide contenant de l'hydroxyde d'aluminium et de l'hydroxyde de magnésium sur la pharmacocinétique de la capécitabine a été étudié. Les concentrations plasmatiques de la capécitabine et de l'un de ses métabolites (5'-DFCR) ont légèrement augmenté ; aucun effet n'a été constaté sur les trois métabolites majeurs (5'-DFUR, 5-FU et FBAL).
Allopurinol
Des interactions entre le 5-FU et l'allopurinol ont été observées avec une diminution possible de l'efficacité du 5-FU. L'administration concomitante de l'allopurinol avec la capécitabine doit être évitée.
Interféron alpha
Associé à l'interféron alpha-2a (3 MUI/m² par jour), la DMT de la capécitabine était de 2000 mg/m² par jour, alors qu'elle était de 3 000 mg/m² par jour lorsque la capécitabine était utilisée seule.
Radiothérapie
La DMT de la capécitabine administrée en monothérapie, avec un schéma intermittent, est de 3000 mg/m² par jour, alors qu'en association à la radiothérapie pour le cancer rectal, la DMT de la capécitabine est de 2000 mg/m² par jour administrée soit en schéma continu, soit quotidiennement du lundi au vendredi pendant une cure de radiothérapie de 6 semaines.
Oxaliplatine
Aucune différence cliniquement significative d'exposition à la capécitabine ou à ses métabolites, au platine libre ou au platine total n'a été observée lorsque la capécitabine a été administrée en association à l'oxaliplatine avec ou sans bévacizumab.
Bévacizumab
Il n'y a pas eu d'effet cliniquement significatif du bévacizumab sur les paramètres pharmacocinétiques de la capécitabine ou de ses métabolites, en présence d'oxaliplatine.
Interaction avec l'alimentation
Dans tous les essais cliniques, les patients devaient prendre la capécitabine dans les 30 minutes suivant un repas. Les données actuelles de tolérance et d'efficacité étant fondées sur une telle administration, il est recommandé de prendre la capécitabine selon ce schéma. La prise de nourriture diminue l'absorption de la capécitabine .

 Français
Français Русский
Русский